题目内容
7.下列各组离子在溶液中能大量共存的是( )| A. | Na+、OH-、S2O${\;}_{3}^{2-}$、Cl- | B. | Fe2+、K+、H+、NO${\;}_{3}^{-}$ | ||
| C. | H+、C2O${\;}_{4}^{2-}$、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | D. | Na+、Ca2+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B错误;
C.C2O42-、H+、MnO4-发生氧化还原反应,不能共存,故C错误;
D.AlO2-促进HCO3-的电离生成沉淀,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
17. 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )| A. | 装置乙的b极要与装置甲的X极连接 | |
| B. | 装置乙中a极的电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | N电极发生还原反应,当N电极消耗56 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
15.下列古代发明与所给化学变化对应错误的是( )
| 选项 | 古代发明 | 化学变化 |
| A | 生产陶瓷 | SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
| B | 黑火药爆炸 | S+2KNO3+3C$\frac{\underline{\;点燃\;}}{\;}$K2S+N2↑+3CO2↑ |
| C | 湿法炼铜 | CuSO4+Fe═Cu+FeSO4 |
| D | 用谷物酿酒 | (C6H10O5)n→C6H12O6→CH3CH2OH |
| A. | A | B. | B | C. | C | D. | D |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含电子数目为10NA | |
| B. | 标准状况下,11.2L己烷所含有的分子数为0.5NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 常温下,4gCH4含有2NA个C-H共价键 |
2.下列说法正确的是( )
| A. | 可逆反应的化学反应速率是指正反应速率 | |
| B. | 在可逆反应里正反应的速率是正值,逆反应的速率是负值 | |
| C. | 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度 | |
| D. | 对于可逆反应来说,反应物转化为生成物没有一定的限度 |
3.将PH=3的醋酸和硫酸,分别用蒸馏水稀释至原溶液体积的a倍和b倍,稀释后两溶液的PH仍相等,则a和b的关系是( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |

 ,属于弱电解质的是H2O、Al(OH)3.
,属于弱电解质的是H2O、Al(OH)3. 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
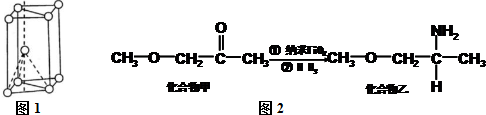
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).