题目内容
8.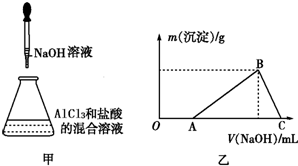 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.请回答下列问题:
(1)溶解AlCl3固体所用的玻璃仪器有bd(填字母).
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为OH-+H+═H2O.
(3)BC段反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是立即出现白色沉淀.
(5)向C点对应的溶液中通入过量的CO2,观察到有白色沉淀生成,反应的离子方程式为AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
分析 首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应3NaOH+AlCl3=3NaCl+Al(OH)3↓,最后发生NaOH+Al(OH)3=NaAlO2+2H2O,沉淀溶解.
解答 解:首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应3NaOH+AlCl3=3NaCl+Al(OH)3↓,最后发生NaOH+Al(OH)3=NaAlO2+2H2O,沉淀溶解,
(1)溶解AlCl3固体,应该在烧杯里并且用玻璃棒不断的搅拌,故选:bd;
(2)根据以上分析OA段反应的离子方程式为OH-+H+═H2O,故答案:OH-+H+═H2O;
(3)根据以上分析BC段反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案:OH-+Al(OH)3=AlO2-+2H2O;
(4)根据以上分析B点时氢氧化铝刚好完全沉淀,溶液的只剩NaCl,所以滴加AgNO3溶液,观察到的现象立即出现白色沉淀,故答案:立即出现白色沉淀;
(5)向NaAlO2溶液中通入过量CO2,反应的离子方程式为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
点评 本题以图象形式考查混合物的有关计算,清楚各阶段发生的反应是关键.

练习册系列答案
相关题目
7.四种多硼酸根离子的结构示意图如下,有关叙述正确的是( )


| A. | x=2 | B. | y=3 | ||
| C. | z=4 | D. | 图(d)的化学式为BO2 |
19.下列叙述不正确的是( )
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
13.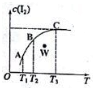 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |
20.下列物质中属于电解质且能导电的是( )
| A. | Cu | B. | NaOH溶液 | C. | 熔融Na2CO3 | D. | 乙醇 |
18.能正确表示下列化学反应的离子方程式的是 ( )
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |