题目内容
3.(1)0.020mol/L的HCN(aq)与0.020mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+)>c(CN-),用“>、<、=”符号填空①溶液中c(OH -)>c(H +)②c (HCN)>c(CN-)
(2)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH.
②分别用0.1mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是CH3COOH.
③反应开始时,反应速率D.
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(3)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时c(OH -)=2.0×10-7mol/L.相同条件下,测得①NaHCO3(aq)②CH3COONa(aq)③NaClO(aq)三种稀
溶液的pH值相同.它们的物质的量浓度由大到小的顺序是②①③.
分析 (1)混合溶液中存在电荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),因为c(CN-)<c(Na+),所以c(OH-)>c(H+),混合溶液呈碱性,说明HCN的电离程度小于CN-的水解程度;
(2)①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比;
③反应速率与氢离子浓度成正比;
(3)纯水中c(H+)=c(OH-),水的离子积Kw=c(H+).c(OH-);
对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液pH越大;当pH相同时,酸越强,盐的浓度越大.
解答 解:(1)混合溶液中存在电荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),因为c(CN-)<c(Na+),所以c(OH-)>c(H+),混合溶液呈碱性,说明HCN的电离程度小于CN-的水解程度,所以c (HCN)>c (CN-);
故答案为:>;>;
(2)①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其浓度大小顺序是CH3COOH>HCl>H2SO4,则浓度最大的是CH3COOH;
故答案为:CH3COOH;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比,pH相等、体积相等的硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量浓度最大,则相同体积同pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以消耗氢氧化钠体积最多的是CH3COOH;
故答案为:CH3COOH;
③反应速率与氢离子浓度成正比,开始时,三种酸中氢离子浓度相等,所以其开始反应速率相等,故答案为:D;
(3)任何温度下,纯水均显中性,即纯水中都存在c(H+)=c(OH-)=2.0×10-7 mol•L-1,水的离子积Kw=c(H+).c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14;在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即②>①>③.
故答案为:2.0×10-7,②①③.
点评 本题考查较综合,涉及弱电解质的电离、酸碱混合溶液定性判断、反应速率的判断、纯水显中性来求算水的离子积kw以及盐溶液“越弱越水解:的规律等知识点,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
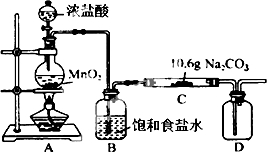 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)该实验装置明显存在不足之处,改进的措施为在装置D后连接以尾气处理装置
(3)已知在装置C中通入一定量的氯气后,观察到测得D中有黄红色的气体(提示:是一种氯的氧化物).已知C中所得固体含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3、NaCl
假设二:存在三种成分,为NaHCO3、Na2CO3、NaCl
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 步骤 | 预期现象和结论 |
| 步骤1:取C中少量样品于试管中,滴加足量蒸馏水 至溶解,然后将所得溶液分别置于A、B试管中 | 固体物质全部完全溶解 |
| 步骤:向A试管中滴加适量BaCl溶液 | a. 如果 b. 如果 |
| 步骤: | 有白色沉淀生成,C的部分有NaCl |
若C中有0.1molCl2恰好与10.6gNa2CO3反应,且假设一成立,由此可推知C中反应生成的氯的氧化物为Cl2O(写化学式),写出C中发生反应的化学方程式2Cl2+2Na2CO3+H2O═2NaCl+2NaHCO3+Cl2O.
| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
 氟是非金属性最强的元素.
氟是非金属性最强的元素.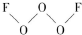 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.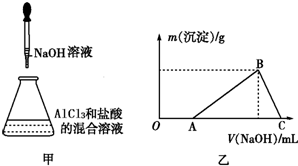 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示. 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: