题目内容
19.下列叙述不正确的是( )| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
分析 A、电镀时,镀层作阳极,镀件作阴极;
B、根据原电池能加快化学反应速率来回答;
C、阳极材料为粗铜,有比铜活泼的金属先放电,阴极上是铜离子得电子的还原反应;
D、甲醇燃料电池是碱性环境,负极是燃料失电子的氧化反应.
解答 解:A、电镀铜时,铜作阳极,阳极上铜失电子发生氧化反应,镀件作阴极,阴极上铜离子放电生成铜,故A正确;
B、锌与硫酸反应生成氢气,粗锌和硫酸形成原电池,原电池能加快化学反应速率,故B正确;
C、阳极材料为粗铜,有比铜活泼的金属先放电,粗铜电极上每转移0.2mole-,阴极上是铜离子得电子发生还原反应,得到金属铜是6.4g,故C正确;
D、甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极上发生的反应为:CH3OH+8OH--6e-═CO32-+6H2O,故D错误.
故选D.
点评 本题考查原电池,明确原电池的应用是解题的关键,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
7.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
4.一定质量的混合气体在密闭容器中发生如下反应:xA(气)+yB(气)?zC(气).达到平衡后,测得A气体的浓度为0.5mol/L.当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L.下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |
11.将15g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加9g,则原溶液中硝酸的浓度为( )
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
9.AgN03是一种重要的化学试剂,精炼铜的阳极泥中含有较多的银,可用于制备AgN03,主要工艺流程如图:

已知:AgNO3与Cu( N03)2受热易分解,分解温度如表所示.
(1)黑色固体D的化学式为CuO,①中加热温度的范围应控制在473-673K.
(2)如表为不同温度时AgNO3的溶解度
据此判断,②中从溶液Ⅱ中获得纯净的AgN03晶体的主要操作为:蒸发浓缩→过滤冷却结晶→过滤→洗涤→干燥.
(3)气体甲可以与NaOH溶液反应,产物之一为NaN02.已知常温时Ka(HN02)=4.9x10-4,常温下将0.1mol•L-1 NaOH溶液与0.2mol•L-1HN02溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(NO2-)>c(Na+)>c(H+)>c(OH-).
(4)另一种提纯AgN03溶液的方法为:向含有Cu2+的AgNO3溶液中加入某固体,充分反应后滤去蓝色沉淀即可,该固体可以为D(填选项字母).
A.NaOH B.AgCl C.FeS D.Ag2O
(5)制得的AgN03可配制为标准溶液,在中性或弱碱性溶液中,以K2Cr04为指示剂测定氯化物中Cl-的含量,主要反应为:
Ag++Cl-═AgCl↓ 2Ag++Cr042-(黄色)═Ag2Cr04↓砖红色)
已知Ksp(AgCl)=1.8×lO-10,Ksp(AgCrO4)=1.2×l0-12,则用该方法测定NaCl溶液中的c(Cl-)时,达到滴定终点时的现象为当滴入最后一滴AgNO3后有砖红色沉淀生成;实验中指示剂K2Cr04的浓度不宜过大,原因为K2CrO4溶液为黄色,浓度过大将影响滴定终点现象的判断(或K2CrO4溶液浓度过大时,有可能会在Cl-未完全沉淀时与Ag+结合,对滴定结果造成误差).

已知:AgNO3与Cu( N03)2受热易分解,分解温度如表所示.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
(2)如表为不同温度时AgNO3的溶解度
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
(3)气体甲可以与NaOH溶液反应,产物之一为NaN02.已知常温时Ka(HN02)=4.9x10-4,常温下将0.1mol•L-1 NaOH溶液与0.2mol•L-1HN02溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(NO2-)>c(Na+)>c(H+)>c(OH-).
(4)另一种提纯AgN03溶液的方法为:向含有Cu2+的AgNO3溶液中加入某固体,充分反应后滤去蓝色沉淀即可,该固体可以为D(填选项字母).
A.NaOH B.AgCl C.FeS D.Ag2O
(5)制得的AgN03可配制为标准溶液,在中性或弱碱性溶液中,以K2Cr04为指示剂测定氯化物中Cl-的含量,主要反应为:
Ag++Cl-═AgCl↓ 2Ag++Cr042-(黄色)═Ag2Cr04↓砖红色)
已知Ksp(AgCl)=1.8×lO-10,Ksp(AgCrO4)=1.2×l0-12,则用该方法测定NaCl溶液中的c(Cl-)时,达到滴定终点时的现象为当滴入最后一滴AgNO3后有砖红色沉淀生成;实验中指示剂K2Cr04的浓度不宜过大,原因为K2CrO4溶液为黄色,浓度过大将影响滴定终点现象的判断(或K2CrO4溶液浓度过大时,有可能会在Cl-未完全沉淀时与Ag+结合,对滴定结果造成误差).
 氟是非金属性最强的元素.
氟是非金属性最强的元素.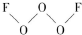 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.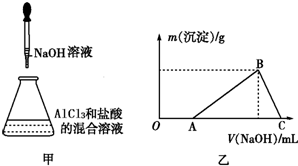 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.