题目内容
氮是大气中含量最多的一种元素,氮及其化合物在生产、生活中有着重要作用.请回答:
(1)下列变化属于“氮的固定”的是 (填字母)
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
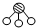
(2)据报道,意大利科学家获得了极具研究价值的N4,其分子结构如图1所示.
已知Ⅰ.断裂1mol N-N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,
Ⅱ.N2 (g)+3H2(g)2NH3(g)△H=-92.2kJ?mol-1则:N4 (g)+6H2 (g)4NH3(g)△H= kJ?mol-1
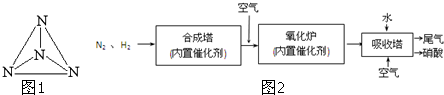
(3)图2是工业生产硝酸的流程.
①1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:
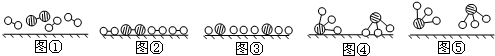
 、
、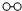 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 、.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 、.
②合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1,该反应的化学平衡常数表达式K= .在一定温度和压强下,将H2和N2按3:1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为 .
③吸收塔中通入空气的目的是 .
(1)下列变化属于“氮的固定”的是
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)据报道,意大利科学家获得了极具研究价值的N4,其分子结构如图1所示.
已知Ⅰ.断裂1mol N-N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,
Ⅱ.N2 (g)+3H2(g)2NH3(g)△H=-92.2kJ?mol-1则:N4 (g)+6H2 (g)4NH3(g)△H=
(3)图2是工业生产硝酸的流程.
①1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程②合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1,该反应的化学平衡常数表达式K=
③吸收塔中通入空气的目的是

考点:氮的固定,工业制取硝酸,热化学方程式,化学平衡的调控作用
专题:化学平衡专题,氮族元素
分析:(1)氮的固定是指将游离态的氮转化为化合态的氮;
(2)Ⅱ、设出N-H的键能和H-H键的键能,根据所给的热化学方程式,求出N-H键和H-H的键能,然后根据△H=断键吸收的能量-成键放出的能量,即可解得;
(3)①、图②→③则表示在催化剂表面,N2、H2中的化学键断裂;图③→④表示在催化剂表面,N、H原子间和形成新的化学键,生成NH3 分子;
②、化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.用符号“K”表示;根据反应方程式 N2(g)+3H2(g)?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,列式求算即可;
③通入空气,提供充足的氧气,以便使NO能够循环利用,全部转化成硝酸.
(2)Ⅱ、设出N-H的键能和H-H键的键能,根据所给的热化学方程式,求出N-H键和H-H的键能,然后根据△H=断键吸收的能量-成键放出的能量,即可解得;
(3)①、图②→③则表示在催化剂表面,N2、H2中的化学键断裂;图③→④表示在催化剂表面,N、H原子间和形成新的化学键,生成NH3 分子;
②、化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.用符号“K”表示;根据反应方程式 N2(g)+3H2(g)?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,列式求算即可;
③通入空气,提供充足的氧气,以便使NO能够循环利用,全部转化成硝酸.
解答:
解:(1)氮的固定是指将游离态的氮转化为化合态的氮,故选C;
(2)设H-H键的键能为XKJ/mol,N-H键的键能为YKJ/mol,据热化学方程式可知:N2 (g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1
942KJ 3X 6Y
故有 942KJ+3XKJ-6YKJ=-92.2kJ 可解得3X-6Y=-1034.2 ①
反应 N4 (g)+6H2 (g)?4NH3(g)
6×167kJ 6XKJ 12YKJ
△H=断键吸收的能量-成键放出的能量=6×167+6X-12Y=1002+2(2X-6Y)=1002+2×(-1034.2)=-1066.4KJ/mol
故答案为:-1066.4;
(3)①分析题中图可以知道,图②→③表示在催化剂表面,N2、H2中化学键断裂,图③→④表示在催化剂表面,N、H原子间和形成新的化学键,生成NH3分子,
故答案为:②→③表示在催化剂表面,N2、H2中化学键断裂;③→④在催化剂表面,N、H原子间和形成新的化学键,生成NH3分子;
②化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.根据以上概念可以写出该反应的化学平衡常数表达式 K=
,有反应方程式:N2(g)+3H2(g)?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:
=15%,解得x≈0.78nmol,H2 的转化率为:0.78nmol÷3nmol×100%=26%,
故答案为:K=
; 26%;
③不断通入空气,提供充足的氧气,以便使NO循环利用,全部转化成硝酸,故答案为:使NO循环利用,全部转化成硝酸.
(2)设H-H键的键能为XKJ/mol,N-H键的键能为YKJ/mol,据热化学方程式可知:N2 (g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1
942KJ 3X 6Y
故有 942KJ+3XKJ-6YKJ=-92.2kJ 可解得3X-6Y=-1034.2 ①
反应 N4 (g)+6H2 (g)?4NH3(g)
6×167kJ 6XKJ 12YKJ
△H=断键吸收的能量-成键放出的能量=6×167+6X-12Y=1002+2(2X-6Y)=1002+2×(-1034.2)=-1066.4KJ/mol
故答案为:-1066.4;
(3)①分析题中图可以知道,图②→③表示在催化剂表面,N2、H2中化学键断裂,图③→④表示在催化剂表面,N、H原子间和形成新的化学键,生成NH3分子,
故答案为:②→③表示在催化剂表面,N2、H2中化学键断裂;③→④在催化剂表面,N、H原子间和形成新的化学键,生成NH3分子;
②化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.根据以上概念可以写出该反应的化学平衡常数表达式 K=
| c2(NH3) |
| c(N2).c3(H2) |
| 2X/3 |
| n-x/3+3n-x+2x/3 |
故答案为:K=
| c2(NH3) |
| c(N2).c3(H2) |
③不断通入空气,提供充足的氧气,以便使NO循环利用,全部转化成硝酸,故答案为:使NO循环利用,全部转化成硝酸.
点评:本题以硝酸的工业制备为背景,综合考查对化学反应中化学键变化、热化学方程式、化学平衡常数、转化率计算等考点以及对图形的观察能力、推理能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A、可与溴水反应,且1mol该物质与足量溴水反应消耗6molBr2 |
| B、可与NaOH溶液反应,1mol该物质可与5molNaOH反应 |
| C、一定条件下1mol该物质可与H2加成,耗H2最大量为6mol |
| D、维生素P能发生水解反应 |
下列说法不正确的是( )
| A、已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| B、SO2、SO3都是极性分子 |
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
| D、金属具有的光泽是金属吸收光子而发生跃迁发出特定波长的光波 |
由CO、CH4和C2H2组成的混合气体4.48L(标况),在足量氧气中充分燃烧后,生成的气体先通过足量的浓H2SO4再通过足量的NaOH溶液,NaOH溶液增重13.2g,则混合气体中含C2H2的物质的量n为( )
| A、n<0.1mol |
| B、n=0.1mol |
| C、0.1mol<n<0.15mol |
| D、无法确定 |