题目内容
下列叙述中完全正确的一组是( )
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③5.6克铁粉与硝酸反应失去的电子一定是0.3NA
④常温常压下,16g O2和O3所含的原子数为NA
⑤1mol C10H22分子中共价键总数为31NA
⑥1mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L水中含分子数为NA.
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③5.6克铁粉与硝酸反应失去的电子一定是0.3NA
④常温常压下,16g O2和O3所含的原子数为NA
⑤1mol C10H22分子中共价键总数为31NA
⑥1mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L水中含分子数为NA.
| A、②③④ | B、②③⑥⑦ |
| C、①②④⑤ | D、②④⑤ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:①甲基(-CH3)中含有9个电子,1mol甲基含有9mol电子;
②0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子;
③5.6克铁粉与硝酸反应,反应产物可能为铁离子或亚铁离子;
④O2和O3中都只含有氧原子,16g混合物中含有16g氧原子;
⑤C10H22分子中含有9个碳碳键、22个碳氢共价键,总共含有31个共价键;
⑥1mol Cl2发生反应时,与氢氧化钠溶液反应转移了1mol电子,与铁反应得到2mol电子;
⑦标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
②0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子;
③5.6克铁粉与硝酸反应,反应产物可能为铁离子或亚铁离子;
④O2和O3中都只含有氧原子,16g混合物中含有16g氧原子;
⑤C10H22分子中含有9个碳碳键、22个碳氢共价键,总共含有31个共价键;
⑥1mol Cl2发生反应时,与氢氧化钠溶液反应转移了1mol电子,与铁反应得到2mol电子;
⑦标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
解答:
解:①1mol甲基(-CH3)中含有9mol电子,所含的电子数为9NA,故①错误;
②0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子,根据电子守恒,则电路通过电子0.2NA,故②正确;
③5.6克铁粉的物质的量为0.1mol,0.1mol铁与足量硝酸反应失去0.3mol电子,硝酸不足,则反应生成亚铁离子,0.1mol铁失去0.2mol电子,所以反应失去的电子不一定是0.3NA,故③错误;
④常温常压下,16g O2和O3所含的氧原子的质量为16g,含有1mol氧原子,含有的原子数为NA,故④正确;
⑤1mol C10H22分子中含有9mol碳碳键、22mol碳氢键,总共含有31mol共价键,含有的共价键总数为31NA,故⑤正确;
⑥1mol Cl2发生反应时,如果与氢氧化钠溶液反应,氯气既是氧化剂也是还原剂,1mol氯气反应转移了1mol电子,转移的电子数一定是NA,故⑥错误;
⑦标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故⑦错误;
根据以上分析,正确的为:②④⑤,
故选D.
②0.2g氢气的物质的量为0.1mol,生成0.1mol氢气转移了0.2mol电子,根据电子守恒,则电路通过电子0.2NA,故②正确;
③5.6克铁粉的物质的量为0.1mol,0.1mol铁与足量硝酸反应失去0.3mol电子,硝酸不足,则反应生成亚铁离子,0.1mol铁失去0.2mol电子,所以反应失去的电子不一定是0.3NA,故③错误;
④常温常压下,16g O2和O3所含的氧原子的质量为16g,含有1mol氧原子,含有的原子数为NA,故④正确;
⑤1mol C10H22分子中含有9mol碳碳键、22mol碳氢键,总共含有31mol共价键,含有的共价键总数为31NA,故⑤正确;
⑥1mol Cl2发生反应时,如果与氢氧化钠溶液反应,氯气既是氧化剂也是还原剂,1mol氯气反应转移了1mol电子,转移的电子数一定是NA,故⑥错误;
⑦标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故⑦错误;
根据以上分析,正确的为:②④⑤,
故选D.
点评:本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,明确标况下气体摩尔体积的使用条件,①为易错点,注意羟基与氢氧根、甲基与甲烷的关系.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列有关糖类、油脂、蛋白质的说法正确的是( )
| A、向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,有白色沉淀产生,说明蛋白质发生了变性 |
| B、棉花、纸、醋酸纤维的主要成分都是纤维素 |
| C、淀粉、牛油、蛋白质都是天然高分子化合物 |
| D、油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
下列依据相关数据作出的推理和判断中,不正确的是( )
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
如图为元素周期表短周期的一部分.下列关于A~F六种元素的叙述正确的是( )

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |
碱金属元素钠的电子层数是( )
| A、一层 | B、二层 | C、三层 | D、四层 |
1L0.1mol?L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
 、
、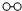 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程