题目内容
由CO、CH4和C2H2组成的混合气体4.48L(标况),在足量氧气中充分燃烧后,生成的气体先通过足量的浓H2SO4再通过足量的NaOH溶液,NaOH溶液增重13.2g,则混合气体中含C2H2的物质的量n为( )
| A、n<0.1mol |
| B、n=0.1mol |
| C、0.1mol<n<0.15mol |
| D、无法确定 |
考点:有关混合物反应的计算
专题:烃及其衍生物的燃烧规律
分析:由CO、CH4和C2H2组成的混合气体在足量氧气中充分燃烧生成二氧化碳与水,生成的气体先通过足量的浓H2SO4,再通过足量的NaOH溶液,NaOH溶液增重13.2g为二氧化碳的质量,令CO、CH4的总物质的量为xmol,C2H2的物质的量为ymol,根据C元素守恒及总体积列方程计算解答.
解答:
解:混合气体总物质的量为:
=0.2mol,NaOH溶液增重13.2g为二氧化碳的质量,其物质的量为
=0.3mol,
令CO、CH4的总物质的量为xmol,C2H2的物质的量为ymol,则:
解得x=y=0.1
故选B.
| 4.48L |
| 22.4L/mol |
| 13.2g |
| 44g/mol |
令CO、CH4的总物质的量为xmol,C2H2的物质的量为ymol,则:
|
解得x=y=0.1
故选B.
点评:本题考查混合物计算,关键是根据化学式中碳原子数目将三组分混合物转化为两组分进行解答,难度中等.

练习册系列答案
相关题目
雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
| A、O2和O3互为同位素 |
| B、O2和O3的相互转化是物理变化 |
| C、在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |
| D、等物质的量的O2和O3含有相同的质量 |
如图为元素周期表短周期的一部分.下列关于A~F六种元素的叙述正确的是( )

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |
1L0.1mol?L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作宝石.已知该尖晶石中混有Fe2O3.5.68g该样品恰好能完全溶解在100mL一定浓度的盐酸中,则该盐酸的浓度可能是( )
| A、4.6mol/L |
| B、3.2mol/L |
| C、2.5mol/L |
| D、1.2mol/L |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O
KIO3+3H2↑.下列有关说法不正确的是( )
| ||
| A、电解转移3mol e-时,理论上可制得KIO3 107 g |
| B、电解时,石墨作阳极,不锈钢作阴极 |
| C、电解时的阳极电极反应式:I--6e-+3H2O═IO3-+6H+ |
| D、电解过程中电解质溶液的pH变小 |
 、
、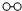 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程