题目内容
把6mol A气体和4mol B气体混合放入5L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经2min达到平衡,此时生成C为3mol,测定D的平均反应速率为0.45mol?L-1?min-1.则
(1)x=
(2)平衡时A的浓度为 B的转化率为
(3)该条件下此反应的平衡常数k= .
(1)x=
(2)平衡时A的浓度为
(3)该条件下此反应的平衡常数k=
考点:化学平衡的计算
专题:化学平衡专题
分析:根据三段式计算出各组分物质的量变化量、平衡时物质的量,
(1)利用化学计量数之比等于物质的量之比计算x;
(2)A的浓度=
计算得到,B的转化率=
×100%;
(3)依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
(1)利用化学计量数之比等于物质的量之比计算x;
(2)A的浓度=
| n |
| V |
| 消耗量 |
| 起始量 |
(3)依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
解答:
解:平衡时生成C为3mol,D的平均反应速率为0.45mol/(L?min),生成D的物质的量为0.45mol/(L?min)×2min×5L=4.5mol,则:
3A(g)+B(g)?2C(g)+xD(g)
起始量(mol) 6 4 0 0
变化量(mol) 4.5 1.5 3 4.5
平衡量(mol) 1.5 2.5 3 4.5
(1)物质的量之比等于化学计量数之比,故3:4.5=2:x,则x=3,故答案为:3;
(2)平衡时A的浓度=
=0.3mol/L,B的转化率为=
×100%=37.5%,故答案为:0.3mol/L;37.5%;
(3)反应平衡常数K=
=19.44,故答案为:19.44.
3A(g)+B(g)?2C(g)+xD(g)
起始量(mol) 6 4 0 0
变化量(mol) 4.5 1.5 3 4.5
平衡量(mol) 1.5 2.5 3 4.5
(1)物质的量之比等于化学计量数之比,故3:4.5=2:x,则x=3,故答案为:3;
(2)平衡时A的浓度=
| 1.5mol |
| 5L |
| 1.5mol |
| 4mol |
(3)反应平衡常数K=
(
| ||||
(
|
点评:本题考查了化学平衡的计算,主要是平衡浓度、平衡转化率、平衡常数的计算应用,注意对速率公式的理解与灵活运用,注意三段式应用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有( )
| A、28种 | B、32种 |
| C、40种 | D、48种 |
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作宝石.已知该尖晶石中混有Fe2O3.5.68g该样品恰好能完全溶解在100mL一定浓度的盐酸中,则该盐酸的浓度可能是( )
| A、4.6mol/L |
| B、3.2mol/L |
| C、2.5mol/L |
| D、1.2mol/L |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O
KIO3+3H2↑.下列有关说法不正确的是( )
| ||
| A、电解转移3mol e-时,理论上可制得KIO3 107 g |
| B、电解时,石墨作阳极,不锈钢作阴极 |
| C、电解时的阳极电极反应式:I--6e-+3H2O═IO3-+6H+ |
| D、电解过程中电解质溶液的pH变小 |
把95g含有某一种氯化物杂质的氯化镁粉末溶于水后,与足量AgNO3溶液反应,生成300g AgCl沉淀,则该氯化镁中的杂质可能是( )
| A、NaCl |
| B、A1C13 |
| C、KCl |
| D、CaCl2 |
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A、在1 L 0.2mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Na参加氧化还原反应,Na转移的电子数目一定是0.1NA |
| C、电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量减少64克 |
| D、18.0g重水(D2O)所含的电子数为10NA |
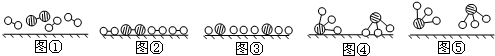
 、
、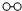 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程