题目内容
 现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:(1)NH4Cl溶液中各种离子的浓度由大到小的顺序是
(2)用水稀释氨水时,溶液中
| C(NH3?H2O) |
| C(OH-) |
(3)将浓度均为0.001mol.L-1的醋酸和盐酸分别与1L pH=11的NaOH溶液充分反应中性,所消耗的CH3COOH和HCl的体积分别为v1和v2,则v1和v2的大小关系为v1
(4)pH相同的等体积醋酸和盐酸,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的体积相同(相同条件下),则下列说法正确的是
A.反应所需要的时间CH3COOH<HCl B.开始反应时的速率HCl>CH3COOH
C.参加反应的锌粉物质的量相等 D.CH3COOH溶液中的锌粉剩余
(5)在10mL 0.1mol.L-1盐酸中逐滴加入0.2mol.L-1氨水,溶液的pH变化曲线如图所示,有关粒子浓度关系比较正确的是
A.在a、c间任意一点,溶液中可能有:c(H+)>c(Cl-)>c(OH-)>c(NH4+)
B.在a、b间任意一点,一定有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.在b点,V1>5mL,且有c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.在c点,c(NH3.H2O)+c(NH4+)=2c(Cl-)
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据NH4Cl是强酸弱碱盐,水解显酸性来分析;
(2)根据电离平衡常数K来分析;
(3)根据醋酸是弱酸,生成的醋酸钠呈碱性,盐酸是强酸,生成的氯化钠呈中性来分析;
(4)A、根据反应过程中醋酸的电离被促进,故反应过程中醋酸中氢离子浓度大来分析;
B、开始时氢离子的浓度相同;
C、根据放出的氢气的体积相同来分析;
D、根据两份酸溶液中氢离子的总量来分析.
(5)A、根据在a、c间任意一点,加入的氨水会将氢离子消耗来分析;
B、根据在a、b间任意一点溶液的组成来分析;
(2)根据电离平衡常数K来分析;
(3)根据醋酸是弱酸,生成的醋酸钠呈碱性,盐酸是强酸,生成的氯化钠呈中性来分析;
(4)A、根据反应过程中醋酸的电离被促进,故反应过程中醋酸中氢离子浓度大来分析;
B、开始时氢离子的浓度相同;
C、根据放出的氢气的体积相同来分析;
D、根据两份酸溶液中氢离子的总量来分析.
(5)A、根据在a、c间任意一点,加入的氨水会将氢离子消耗来分析;
B、根据在a、b间任意一点溶液的组成来分析;
解答:
解:(1)NH4Cl中存在电荷守恒:C(NH4+)+C(H+)=C(Cl-)+C(OH-),而NH4Cl是强酸弱碱盐,水解显酸性,即有:C(H+)>C(OH-),故可得:
C(NH4+)<C(Cl-),再根据盐类的水解程度是很微弱的,故水解生成的C(H+)小于未水解的C(NH4+),故有:C(Cl-)>C(NH4+)>C(H+)>C(OH-),故答案为:C(Cl-)>C(NH4+)>C(H+)>C(OH-);
(2)用水稀释氨水时电离平衡常数K不变,而K=
,用水稀释氨水时,溶液中的C(NH4+)逐渐变小,故
逐渐增大,故溶液
逐渐减小,故答案为:减小;
(3)浓度均为0.001mol.L-1的醋酸和盐酸分别与1L pH=11的NaOH溶液时,若均恰好与氢氧化钠反应时,则v1=v2,但盐酸是强酸,生成的氯化钠呈中性,而醋酸是弱酸,生成的醋酸钠呈碱性,故若想使醋酸反应后也呈中性,必须让醋酸稍微过量,即v1>v2,故答案为:>;
(4)A、反应刚开始时,溶液的PH相同,C(H+)浓度相同,但盐酸是强电解质,完全电离,反应过程中氢离子浓度下降快,而醋酸是弱电解质,部分电离,故反应过程中醋酸的电离被促进,氢离子浓度降低慢,故反应过程中醋酸中的氢离子浓度大于盐酸中的,即醋酸与锌反应更快,所用的时间更短,故A正确;
B、开始时pH相同,即氢离子的浓度相同,故反应速率HCl=CH3COOH,故B错误;
C、放出的氢气的体积相同,故消耗的锌的量相同,故C正确;
D、pH相同的等体积醋酸和盐酸,n(CH3COOH)>n(HCl),分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的体积相同,说明反应掉的锌的物质的量相同,即消耗的氢离子的物质的量相同,故有剩余的酸是醋酸,即醋酸中的锌粉完全反应,故D错误.
故选AC.
(5)A、根据在a、c间任意一点,加入的氨水会将氢离子消耗,会导致c(H+)<c(Cl-),故A错误;
B、在a、b间任意一点时,溶液的酸性强弱不同.如果加入的氨水的量很少,则所得的溶液是大量过量的HCl和极少量的NH4Cl,此时溶液中的离子浓度的关系可能为:
c(Cl-)>c(H+)>c(NH4+)>c(OH-),故B错误;
C、当加入5ml氨水时,盐酸和氨水恰好完全反应生成NH4Cl,溶液呈酸性,故若使溶液pH=7,必须氨水稍微过量,即V1>5mL,根据溶液的电荷守恒可知有:c(NH4+)+c(H+)=c(Cl-)+c(OH-),而溶液呈中性,故有:(H+)=c(OH-),故可知:c(NH4+)=c(Cl-)>c(OH-)=c(H+),故C正确;
D、在c点,加入的氨水的物质的量是盐酸的二倍,所得的溶液中的溶质是NH3.H2O和NH4Cl,根据物料守恒可知有:c(NH3.H2O)+c(NH4+)=2c(Cl-),故D正确.
故选CD.
C(NH4+)<C(Cl-),再根据盐类的水解程度是很微弱的,故水解生成的C(H+)小于未水解的C(NH4+),故有:C(Cl-)>C(NH4+)>C(H+)>C(OH-),故答案为:C(Cl-)>C(NH4+)>C(H+)>C(OH-);
(2)用水稀释氨水时电离平衡常数K不变,而K=
| C(NH4+)?C(OH-) |
| C(NH3?H2O) |
| C(OH-) |
| C(NH3?H2O) |
| C(NH3?H2O) |
| C(OH-) |
(3)浓度均为0.001mol.L-1的醋酸和盐酸分别与1L pH=11的NaOH溶液时,若均恰好与氢氧化钠反应时,则v1=v2,但盐酸是强酸,生成的氯化钠呈中性,而醋酸是弱酸,生成的醋酸钠呈碱性,故若想使醋酸反应后也呈中性,必须让醋酸稍微过量,即v1>v2,故答案为:>;
(4)A、反应刚开始时,溶液的PH相同,C(H+)浓度相同,但盐酸是强电解质,完全电离,反应过程中氢离子浓度下降快,而醋酸是弱电解质,部分电离,故反应过程中醋酸的电离被促进,氢离子浓度降低慢,故反应过程中醋酸中的氢离子浓度大于盐酸中的,即醋酸与锌反应更快,所用的时间更短,故A正确;
B、开始时pH相同,即氢离子的浓度相同,故反应速率HCl=CH3COOH,故B错误;
C、放出的氢气的体积相同,故消耗的锌的量相同,故C正确;
D、pH相同的等体积醋酸和盐酸,n(CH3COOH)>n(HCl),分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的体积相同,说明反应掉的锌的物质的量相同,即消耗的氢离子的物质的量相同,故有剩余的酸是醋酸,即醋酸中的锌粉完全反应,故D错误.
故选AC.
(5)A、根据在a、c间任意一点,加入的氨水会将氢离子消耗,会导致c(H+)<c(Cl-),故A错误;
B、在a、b间任意一点时,溶液的酸性强弱不同.如果加入的氨水的量很少,则所得的溶液是大量过量的HCl和极少量的NH4Cl,此时溶液中的离子浓度的关系可能为:
c(Cl-)>c(H+)>c(NH4+)>c(OH-),故B错误;
C、当加入5ml氨水时,盐酸和氨水恰好完全反应生成NH4Cl,溶液呈酸性,故若使溶液pH=7,必须氨水稍微过量,即V1>5mL,根据溶液的电荷守恒可知有:c(NH4+)+c(H+)=c(Cl-)+c(OH-),而溶液呈中性,故有:(H+)=c(OH-),故可知:c(NH4+)=c(Cl-)>c(OH-)=c(H+),故C正确;
D、在c点,加入的氨水的物质的量是盐酸的二倍,所得的溶液中的溶质是NH3.H2O和NH4Cl,根据物料守恒可知有:c(NH3.H2O)+c(NH4+)=2c(Cl-),故D正确.
故选CD.
点评:本题考查了pH的有关计算以及盐溶液中离子浓度的大小比较,难度较大,综合性较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
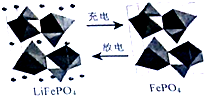 锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )
锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )| A、充电时该电极为阴极 |
| B、放电时该电极的反应式为FePO4+e-+Li+=LiFePO4 |
| C、放电时Li+向负极移动 |
| D、该电池可以用硫酸溶液作电解质 |
 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
下列有关实验操作、现象或实验原理叙述错误的是( )
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、NaHSO3和NaHCO3的中性混合溶液中:c(Na+)=c(HSO3-)+2c(SO32-)+c(HCO3-)+2c(CO32-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<②<③ |
| D、等体积物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
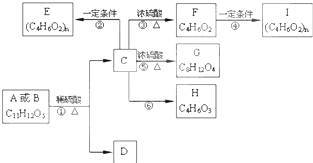 两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.
两种有机物A、B的分子式均为C11H12O5,均能发生如图变化. 如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.