题目内容
14.设NA为阿伏加德罗常数的值.下列有关说法正确的是( )| A. | 32gCu在足量O2或硫蒸气中完全燃烧失去的电子数均为NA | |
| B. | 4g甲烷和8g甲醇含有的氢原子数均为NA | |
| C. | 标准状况下,5.6L乙烷中含有的共价键数目为1.5NA | |
| D. | 一定条件下,32gSO2与足量O2反应,转移电子数为NA |
分析 A.铜与氧气反应生成氧化铜,铜与硫单质反应生成的是氯化亚铜;
B.分别求算甲烷和甲醇中氢原子数目;
C.求出乙烷的物质的量,然后根据1mol乙烷中含7mol共价键来分析计算;
D.二氧化硫和氧气的反应为可逆反应.
解答 解:A.64g铜的物质的量为$\frac{64g}{64g/mol}$=1mol,1molCu与氧气反应生成CuO,产物中Cu元素的化合价为+2价,则反应中转移电子的物质的量为2mol,转移的电子数为2NA,1molCu与硫蒸气反应生成0.5molCu2S,产物中Cu元素的化合价为+1价,则反应中转移电子的物质的量为1mol,转移的电子数为NA,故电子数不全是NA,故A错误;
B.4g甲烷的物质的量为n(CH4)=$\frac{4g}{16g/mol}$=0.25mol,则n(H)=0.25mol×4=1mol,则氢原子数为NA,8g甲醇的物质的量为n(CH3OH)=$\frac{8g}{32g/mol}$=0.25mol,则n(H)=0.25mol×4=1mol,则氢原子数为NA,故氢原子数均为NA,故B正确;
C.5.6L乙烷的物质的量n=$\frac{5.6L}{22.4L/mol}$=0.25mol,而1mol乙烷中含7mol共价键,故0.25mol乙烷中含1.75mol共价键,故C错误;
D.二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故D错误,
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.T1℃时.在2L的密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡,反应过程中部分数据见下表.下列说法正确的是( )
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| A. | 达到平衡时,反应Ⅰ、Ⅱ对比,平衡常数:K(Ⅰ)>K(Ⅱ) | |
| B. | 对于反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 | |
| C. | 对于反应Ⅰ,若30min时只改变温度为T2℃,再次达到平衡时H2的物质的量为3.2mol,则T1>T2 | |
| D. | 对于反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡正向移动 |
5.有一种盐A和KOH反应,生成有刺激性气味的气体B,B经过一系列氧化再溶于水可得到酸C,B和C反应又可以生成A,则A是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4NO3 | D. | NH4NO2 |
2.下列物质属于烃的是( )
| A. | CH4 | B. | H2CO3 | C. | CH3Cl | D. | HCl |
19.下列说法正确的是( )
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖  的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的  最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
6.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 10g 46%的乙醇水溶液中,氧原子的个数为0.4NA | |
| B. | 等物质的量的氧化钠和过氧化钠晶体中所含有的阴离子数均为NA | |
| C. | 标准状况下,22.4 L 环己烷中所含有的非极性键的数目为6NA | |
| D. | 向含有0.1mol的FeI2溶液中通入0.1mol Cl2,充分反应后转移的电子数为0.3NA |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol SO2、O2的混合气体,充分反应达到平衡后体系内氧原子数目为0.2NA | |
| B. | 0.1 mol ${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 标准状况下,22.4 L空气中单质分子数目为NA | |
| D. | 100 g质量分数是98%的浓硫酸中所含氧原子数为4NA |
17.化学与生活密切相关,下列叙述中正确的是( )
| A. | 纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质 | |
| B. | 补钙剂中常含有维生素D,其作用是为了促进钙的吸收 | |
| C. | 天然存在的动植物油脂,大多属于单甘油酯 | |
| D. | 蛋白质的盐析属于化学变化,可用于分离、提纯蛋白质 |
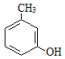 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$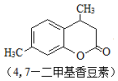 +C2H5OH+H2O
+C2H5OH+H2O