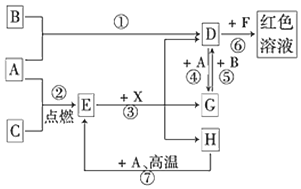
题目内容
6.NA为阿伏伽德罗常数,下列说法正确的是( )| A. | 10g 46%的乙醇水溶液中,氧原子的个数为0.4NA | |
| B. | 等物质的量的氧化钠和过氧化钠晶体中所含有的阴离子数均为NA | |
| C. | 标准状况下,22.4 L 环己烷中所含有的非极性键的数目为6NA | |
| D. | 向含有0.1mol的FeI2溶液中通入0.1mol Cl2,充分反应后转移的电子数为0.3NA |
分析 A、乙醇溶液中除了乙醇外,水也含氧原子;
B.过氧化钠中的阴离子为过氧根离子,氧化钠中的阴离子为氧离子;
C.标况下环己烷为液体;
D.根据碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子分析.
解答 解:A.乙醇溶液中除了乙醇外,水也含氧原子,10g46%的乙醇溶液中,乙醇的质量为4.6g,物质的量为0.1mol,故含0.1mol氧原子;水的质量为10g-4.6g=5.4g,物质的量为0.3mol,故含0.3mol氧原子,故此溶液中含有的氧原子的物质的量共为0.4mol,即个数为0.4NA个,故A正确;
B.1molNa2O和1molNa2O2中阴离子数均为1mol,故等物质的量的氧化钠和过氧化钠晶体中所含有的阴离子数均为NA,故B正确;
C.标况下环己烷为液体,故环己烷的物质的量不能根据气体摩尔体积来计算,故C错误;
D.FeI2溶液中,碘离子的还原性大于亚铁离子的,通入氯气,先发生的反应为2I-+Cl2=I2+2Cl-~2mole-,则0.1molFeI2含碘离子0.2mol,由方程式得0.2molI-需要0.1molCl2,转移0.2mol电子,故通入0.1mol Cl2充分反应后转移的电子数为0.2NA,故D错误,
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
16.下列叙述不正确的是( )
| A. | 100℃纯水的pH<7,此时水仍呈中性 | |
| B. | pH=3的醋酸溶液,稀释至100倍后pH小于5 | |
| C. | 0.2 mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
17.下列有关有机物的说法正确的是( )
| A. | 1mol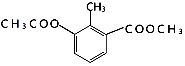 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. | 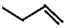 系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. | 1mol 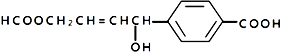 可以与4molH2发生加成 可以与4molH2发生加成 | |
| D. | 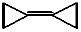 的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 |
14.设NA为阿伏加德罗常数的值.下列有关说法正确的是( )
| A. | 32gCu在足量O2或硫蒸气中完全燃烧失去的电子数均为NA | |
| B. | 4g甲烷和8g甲醇含有的氢原子数均为NA | |
| C. | 标准状况下,5.6L乙烷中含有的共价键数目为1.5NA | |
| D. | 一定条件下,32gSO2与足量O2反应,转移电子数为NA |
11.下列实验现象和结论相对应且正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中存在Na+、不含K+ |
| B | 用浓盐酸和石灰石反应声生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 将石蜡油在碎瓷片上加热,产生的气体通过酸性KMnO4溶液 | 酸性KMnO4溶液紫红色褪去 | 石蜡油分解产生了不同于烷烃的气体,且该气体具有还原性 |
| D | 某溶液加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42-或者Ag+ |
| A. | A | B. | B | C. | C | D. | D |
18.自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛( ),杏仁含苯甲醛(
),杏仁含苯甲醛( ).下列说法错误的是( )
).下列说法错误的是( )
 ),杏仁含苯甲醛(
),杏仁含苯甲醛( ).下列说法错误的是( )
).下列说法错误的是( )| A. | 肉桂醛和苯甲醛互为同系物 | |
| B. | 肉桂醛能发生加成反应、取代反应和加聚反应 | |
| C. | 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 | |
| D. | 1mol肉桂醛分子在一定条件下最多与5mol氢气加成 |
8.苯乙烯的结构为  ,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
 ,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
9.下列有关有机化合物的说法正确的是( )
| A. | 石蜡油分解产生的气体能使酸性高锰酸钾溶液褪色,说明该气体中一定含有乙烯 | |
| B. | 聚乙烯塑料中含有大量碳碳双键,容易老化,所以不能做食品包装材料 | |
| C. | 生活中很多有机物,如二糖、多糖、蛋白质、多肽都能发生水解反应 | |
| D. | 有机物 的一氯代物有4种 的一氯代物有4种 |