题目内容
20.下列各组物质的性质变化正确的是( )| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
分析 A.元素的非金属性越强,它的最高价氧化物的水化物酸性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.碱金属单质的熔点随着原子序数的递增而逐渐降低;
D.常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大.
解答 解:A.元素的非金属性越强,它的最高价氧化物的水化物酸性越强,非金属性Cl>N>P>Si,所以酸性:HClO4>HNO3>H3PO4>H2SiO3,故A正确;
B.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,则HCl>H2S,故B错误;
C.碱金属单质的熔点随着原子序数的递增而逐渐降低,即熔点:Rb<K<Na<Li,故C错误;
D.常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大,溶解度:Na2CO3>NaHCO3,故D错误;
故选A.
点评 本题考查元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
11.CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶与乙二胺(H2N-CH2--CH2--NH2),可形成配离子 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
5.1mol下列物质在标准状况下体积为22.4L的是( )
| A. | 水蒸气 | B. | 溴蒸气 | C. | 三氧化硫气体 | D. | 一氧化氮气体 |
12.下列物质间的转化,只通过一步化合反应就能完成的是( )
①N2→NO2 ②S→SO3;③Si→SiO2;④CO2→CO;⑤Fe→FeCl2;⑥Fe(OH)2→Fe(OH)3.
①N2→NO2 ②S→SO3;③Si→SiO2;④CO2→CO;⑤Fe→FeCl2;⑥Fe(OH)2→Fe(OH)3.
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
9.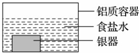 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
( )
 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )
| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
10.对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=4.8 mol/(L•min) | B. | v(A2)=1.5 mol/(L•s) | ||
| C. | v(C)=1.6 mol/(L•s) | D. | v(B2)=1.7 mol/(L•s) |
