题目内容
9.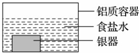 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )
| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
分析 A.形成原电池反应,化学能转化为电能;
B.铝和硫化银在食盐水中形成原电池反应,铝做负极,银器做正极,硫化银被还原为银;
C.铝在原电池中做负极质量减轻;
D.原电池反应中硫化银被还原为银单质.
解答 解:A.将表面发黑的银器浸入盛有食盐水的铝质容器中,形成原电池反应,能量变化是化学能转化为电能,故A错误;
B.图示装置中,铝和硫化银在食盐水中形成原电池,铝做负极,银器做正极,硫化银被还原为银,故B正确;
C.铝在原电池中做负极质量减轻,但是铝为负极,故C错误;
D.原电池反应中硫化银被还原为银单质,不是Ag2S溶解于食盐水生成了AgCl,故D错误;
故选B.
点评 本题考查了原电池工作原理及应用,题目难度不大,正确判断原电池的两极为解答关键,注意熟练掌握原电池工作原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列各组物质的性质变化正确的是( )
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
14.下列有关说法正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
1.酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和 NH4Cl 等组成的糊状填充物.该电池放电过程产生 MnOOH.回收处理该废电池可得到多种化工原料.有关数据如表所示溶解度/(g/100g 水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
18.1828年德国化学家维勒从无机物制得了有机物,打破了只能从有机物取得有机物的学说,这种有机物是( )
| A. | 结晶牛胰岛素 | B. | 氰酸铵 | C. | 葡萄糖 | D. | 尿素 |
 的系统命名是:2,6-二甲基辛烷
的系统命名是:2,6-二甲基辛烷 的键线式是
的键线式是