题目内容
15.原子序数 11~17 的元素,自钠到氯,电子层数相同,最外层电子数从1增加到7,随着核电荷数依次递增,原子半径依次减小,得电子能力逐渐增强,因此,金属性逐渐减弱,非金属性逐渐增强.分析 原子序数 11~17 的元素,自钠到氯,电子层数相同,最外层电子数从1到7;随着原子序数的递增,原子半径减小,核电荷数增大,核对最外层电子的引力增强,失电子能力减弱,得电子能力增强,则金属性减弱,非金属性增强,以此来解答.
解答 解:原子序数 11~17 的元素,自钠到氯都位于第三周期,电子层数相同,最外层电子数从1增大到7;随着核电荷数依次递增,原子半径依次减小,得到电子能力逐渐增强,因此金属性逐渐减弱,非金属性逐渐增强,
故答案为:1;7;减小;增强;减弱;增强.
点评 本题考查同周期元素的性质,为高频考点,题目难度不大,把握同周期元素性质的变化规律为解答的关键,注重基础知识的考查,属于记忆性知识点,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
3.组成为C3H6Cl2的卤代烃,可能存在的同分异构体有( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
20.下列各组物质的性质变化正确的是( )
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
7.足量的SO2气体通入下列溶液中,不会变成无色溶液的是( )
| A. | 紫色石蕊溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 品红溶液 |
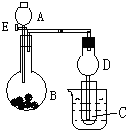 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: