题目内容
12.下列物质间的转化,只通过一步化合反应就能完成的是( )①N2→NO2 ②S→SO3;③Si→SiO2;④CO2→CO;⑤Fe→FeCl2;⑥Fe(OH)2→Fe(OH)3.
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
分析 ①氮气和氧气放电生成一氧化氮,不能一步反应生成二氧化氮;
②S燃烧只能生成二氧化硫;
③Si在氧气中燃烧能生成二氧化硅;
④CO2和C化合能生成CO;
⑤Fe和FeCl3能化合生成FeCl2;
⑥Fe(OH)2和氧气、水化合能生成Fe(OH)3.
解答 解:①氮气和氧气放电生成一氧化氮,不能一步反应生成二氧化氮,故NO2不能氮气的一步化合完成,故错误;
②S燃烧只能生成二氧化硫,故三氧化硫不能通过S的一步化合完成,故错误;
③Si在氧气中燃烧能生成二氧化硅:Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2,故可以通过一步化合完成,故正确;
④CO2和C化合能生成CO:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,故可以一步化合完成,故正确;
⑤Fe和FeCl3能化合生成FeCl2:Fe+2FeCl3=3FeCl2,故可以通过一步化合完成,故正确;
⑥Fe(OH)2和氧气、水化合能生成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故可以通过一步化合完成,故正确.
故选B.
点评 本题考查了物质性质的分析应用,主要是反应一步进行的理解,掌握物质性质是解题的关键,题目较简单.

练习册系列答案
相关题目
2.增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,常用方法有催化重整等.例如以下两个在催化重整时发生的反应:
①CH3(CH2)4CH3$\stackrel{-H_{2}}{→}$ $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$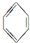
②CH3(CH2)4CH3→
下列叙述正确的是( )
①CH3(CH2)4CH3$\stackrel{-H_{2}}{→}$
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$
②CH3(CH2)4CH3→

下列叙述正确的是( )
| A. | 反应①中间产物和反应②产物互为同分异构体 | |
| B. | 反应①中间产物和最终产物的一氯代物都只有一种 | |
| C. | 反应②产物中的六个碳原子可能在同一平面上 | |
| D. | 反应①②均为消去反应 |
3.组成为C3H6Cl2的卤代烃,可能存在的同分异构体有( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
20.下列各组物质的性质变化正确的是( )
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
7.足量的SO2气体通入下列溶液中,不会变成无色溶液的是( )
| A. | 紫色石蕊溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 品红溶液 |
1.酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和 NH4Cl 等组成的糊状填充物.该电池放电过程产生 MnOOH.回收处理该废电池可得到多种化工原料.有关数据如表所示溶解度/(g/100g 水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
2.如表表格中各项分类都正确的一组是( )
类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 生理盐水 | 明矾 | 液态KNO3 | 蔗糖 |
| B | CaO | 海 水 | 铜 | 乙醇 |
| C | 胆矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |