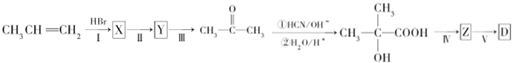题目内容
4.常温下,下列推断正确的是( )| A. | 由水电离出的c(OH-)=1×10-12mol•L-1,pH一定为2 | |
| B. | 将0.02mol•L-1的NaOH溶液.氨水分别稀释a倍、b倍后均得到pH=9的溶液,则a<b | |
| C. | 将pH=1与pH=3的两份盐酸等体积混合后,所得溶液的pH=2(忽略混合时溶液体积的变化) | |
| D. | 等体积的0.2mol•L-1盐酸与0.2mol•L-1氢氧化钡溶液混合后,所得溶液的pH=13(忽略混合时溶液体积的变化) |
分析 A、在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;
B、一水合氨为弱电解质,0.02mol•L-1的NaOH溶液中的氢氧根的浓度远大于氨水中的氢氧根浓度;
C、pH=1和pH=3的盐酸溶液中氢离子浓度分别为0.1mol/L、0.001mol/L,二者等体积混合,可计算混合后的c(H+),进而可计算pH;
D、等体积混合0.2mol•L-1的盐酸和0.2mol•L-1的Ba(OH)2溶液混合,发生H++OH-=H2O,反应后OH-过量,假设体积都为1L,则混合体积为2L,计算出混合液中c(OH-),再计算出溶液的pH.
解答 解:A、25℃时:Kw=c(OH-)×c(H+)=10-14,纯水中c(H+)=c(OH-)=1.0×10-7 mol/L,在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,则pH=2,如果为盐溶液,则pH=12,故A错误;
B、一水合氨为弱电解质,0.02mol•L-1的NaOH溶液中的氢氧根的浓度远大于氨水中的氢氧根浓度,故当加水稀释至pH=9时,加水的体积a大于b,故B错误;
C、pH=1和pH=3的盐酸溶液中氢离子浓度分别为0.1mol/L、0.001mol/L,二者等体积混合,混合后的c(H+)=$\frac{0.1mol/L+0.001mol/L}{2}$=0.05005mol/L,pH=-lg0.05005=1.3,故C错误;
D、假设体积都为1L,则1L0.2mol•L-1的盐酸中n(H+)=0.2mol,1L0.2mol•L-1的Ba(OH)2溶液n(OH-)=0.4mol,等体积混合发生H++OH-=H2O,反应后c(OH-)=$\frac{0.4mol-0.2mol}{2L}$=0.1mol/L,则反应后溶液的pH=13,故D正确.
故选D.
点评 本题考查了pH的简单计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的表达式及计算方法,试题培养了学生的化学计算能力.

| 操作及现象 | 结论 | |
| A | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有白色固体析出 | 蛋白质均发生变性 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有白色沉淀产生,再滴加0.1mol•L-1FeCl3溶液,白色沉淀变为红褐色沉淀 | 在水中的溶解度 Mg(OH)2<Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: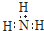 | |
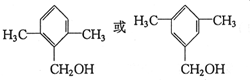
| C. | 苯乙酸钠的结构简式: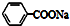 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
| A. | 4:10 | B. | 10:4 | C. | 4:1 | D. | 1:4 |
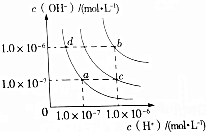
| A. | a点对应温度条件下,将pH=x的氨水稀释10倍后,其pH=y,则x=y+1 | |
| B. | 纯水仅升高温度,可从d点变到b点 | |
| C. | c点对应温度条件下醋酸的电离常数比a点对应温度条件下醋酸的电离常数大 | |
| D. | b点对应温度条件下,0.5mol•L-1的H2SO4溶液与1mol•L-1的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=10-7mol•L-1 |
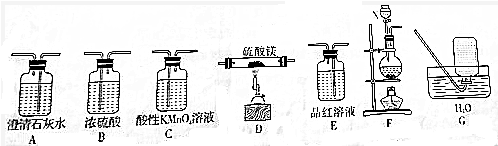
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.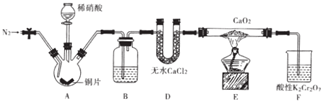
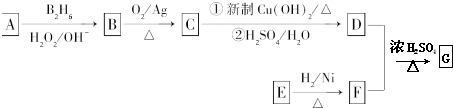
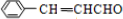 .
. .
.