题目内容
5.乙烯和苯是来自煤和石油的两种重要化工原料,请回答:(1)乙烯的产量是衡量一个国家石油化工发展水平的标志.
(2)苯不能(填“能”或“不能”)使高锰酸钾酸性溶液褪色.
(3)在一定条件下,乙烯和苯都能与溴发生反应.
①请补充下列反应:CH2=CH2+Br2→CH2BrCH2Br.
②苯和溴反应方程式为:
 ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.
分析 (1)乙烯的产量标志着一个国家的石油发展水平;
(2)苯性质较稳定,和一般的氧化剂、强酸、强碱不反应;
(3)①乙烯和溴发生加成反应生成1,2-二溴乙烷;
②苯和溴在溴化铁作催化剂条件下发生取代反应.
解答 解:(1)乙烯的产量标志着一个国家的石油发展水平,所以乙烯的产量是衡量一个国家石油化工发展水平的标志,故答案为:乙烯;
(2)苯性质较稳定,和一般的氧化剂、强酸、强碱不反应,所以苯不能被酸性高锰酸钾溶液氧化,故答案为:不能;
(3)①乙烯和溴发生加成反应生成1,2-二溴乙烷,反应方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2BrCH2Br;
②苯和溴在溴化铁作催化剂条件下发生取代反应生成溴苯和HBr,故答案为:取代.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查乙烯和苯的性质,注意:苯不能被酸性高锰酸钾溶液氧化,但连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化生成苯甲酸,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.下列说法不正确的是( )


| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
10.能正确表示下列反应的离子方程式为( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
17.在90℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1:V2为(已知在90℃时,水的离子积为10-12)( )
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
7.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.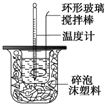
①大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”、“无影响”).
②实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒不能(填“能”、“不能”).
③某同学用0.25mol/L的稀硫酸代替盐酸进行上述实验,实验数据如表
(i)请填写下表中的空白:
(ii)近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8 kJ/mol(保留小数点后一位).
(iii)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.

①大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”、“无影响”).
②实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒不能(填“能”、“不能”).
③某同学用0.25mol/L的稀硫酸代替盐酸进行上述实验,实验数据如表
(i)请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
(iii)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 .
.