题目内容
17.在90℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1:V2为(已知在90℃时,水的离子积为10-12)( )| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
分析 90℃时,水的离子积为10-12,则该温度下c(H+)=$\sqrt{{k}_{w}}$=$\sqrt{1{0}^{-12}}$mol/L=10-6 mol/L,其pH=6,混合溶液pH=11>6,所以混合溶液呈碱性,pH=12的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=l的H2SO4溶液c(H+)=0.1mol/L,混合溶液pH=11,则混合溶液中c(OH-)=$\frac{1×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L=$\frac{1{0}^{-12}}{1{0}^{-11}}$mol/L,据此计算V1:V2.
解答 解:90℃时,水的离子积为10-12,则该温度下c(H+)=$\sqrt{{k}_{w}}$=$\sqrt{1{0}^{-12}}$mol/L=10-6 mol/L,其pH=6,混合溶液pH=11>6,所以混合溶液呈碱性,pH=12的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=l的H2SO4溶液c(H+)=0.1mol/L,混合溶液pH=11,则混合溶液中c(OH-)=$\frac{1×{V}_{1}-0.1×{V}_{2}}{{V}_{1}+{V}_{2}}$mol/L=$\frac{1{0}^{-12}}{1{0}^{-11}}$mol/L,V1:V2=2:9,
故选A.
点评 本题考查酸碱混合溶液定性判断及pH有关计算,为高频考点,侧重考查学生分析计算能力,注意该温度下水的离子积常数不是常温下离子积常数,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.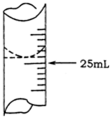 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
据此计算出待测NaOH溶液的物质的量浓度为0.0800 mol•L-1(小数点后保留四位);乙同学判断达到滴定终点时的现象为滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色.
 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
2. 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
6.下列分子中心原子均是sp2杂化的是( )
| A. | PBr3、NO2 | B. | CH4、SCl2 | C. | BF3、SO2 | D. | H2O、CS2 |
19.用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数.⑥重复以上滴定操作2-3次.请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果偏大 (填“偏大”、“偏小”或“无影响”).
(2)步骤④中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果无影响(填“偏大”、“偏小”或“无影响”).
(3)步骤⑤滴定时眼睛应注视锥形瓶中溶液颜色变化;判断到达滴定终点的依据是:锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(4)以下是实验数据记录表
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是AB
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据表中记录数据,通过计算可得,该盐酸浓度为:0.1626mol/L.
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数.⑥重复以上滴定操作2-3次.请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果偏大 (填“偏大”、“偏小”或“无影响”).
(2)步骤④中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果无影响(填“偏大”、“偏小”或“无影响”).
(3)步骤⑤滴定时眼睛应注视锥形瓶中溶液颜色变化;判断到达滴定终点的依据是:锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(4)以下是实验数据记录表
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是AB
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
| 滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据表中记录数据,通过计算可得,该盐酸浓度为:0.1626mol/L.
 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验: ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.