题目内容
13.图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.下列说法不正确的是( )
| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
分析 A.断裂化学键需要热量,形成化学键释放能量;
B.该反应为吸热反应,可知E3>E1,步骤2中放热,可知E2>E3;
C.该反应中反应物总能量小于生成物的总能量;
D.为吸热反应,可知吸收能量大于释放的能量.
解答 解:A.断裂化学键需要热量,形成化学键释放能量,则步骤1为吸热反应,步骤2为放热反应,故A正确;
B.该反应为吸热反应,可知E3>E1,步骤2中放热,可知E2>E3,即E2>E3>E1,故B正确;
C.该反应中反应物总能量小于生成物的总能量,则1mol C发生该反应时吸收的能量为E3-E1,故C正确;
D.为吸热反应,可知吸收能量大于释放的能量,即E2-E1>E2-E3,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、化学键与能量的关系为解答的关键,侧重分析与应用能力的考查,注意判断E的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.己知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
1.在中和滴定中,下列操作或说法不正确的是( )
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
8.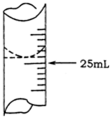 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
据此计算出待测NaOH溶液的物质的量浓度为0.0800 mol•L-1(小数点后保留四位);乙同学判断达到滴定终点时的现象为滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色.
 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为23.80mL.
(2)乙学生做了2组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
2. 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
3.微量元素在人体内含量极少,但它们对于维持生命活动,促进人体健康生长和发育都有极其重要的作用.下列元素中,若缺乏严重会导致智力损害的是( )
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 钠元素 |
 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定. ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.