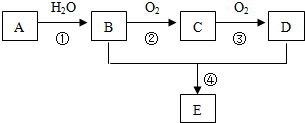
题目内容
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
分析 W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,
A.非金属性O>S,则阴离子的还原性S2->O2-,故A正确;
B.Z为Cl元素,对应的氢化物为强电解质,阴离子不发生水解,不会破坏水的电离平衡,故B错误;
C.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.非金属性O>N,元素的非金属性越强,对应的氢化物越稳定,故D错误.
故选BD.
点评 本题考查原子结构和元素周期律,为高频考点和常见题型,侧重考查学生分析、推断能力,明确元素周期律内涵即可解答,知道非金属性、金属性强弱判断方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.氟是卤族元素之-,由于氟的特殊化学性质,氟化学在化学发展史上有重要的地位.下列有关说法正确的是( )
| A. | 氟原子的结构示意图: | B. | 塑料王聚四氟乙烯的结构简式: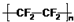 | ||
| C. | 中子数为10的氟原子:${\;}_{9}^{19}$F | D. | 萤石主要成分CaF2电子式: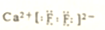 |
17.有关化学键及化合物的说法中,正确的是( )
| A. | 化学键是分子内原子间的相互作用 | |
| B. | 含有阴离子的化合物一定含有阳离子 | |
| C. | 离子化合物熔点一定比共价化合物高 | |
| D. | 非金属元素组成的一定是共价化合物 |
1.X、Y、Z、W、R五种短周期元素,原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R 同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其原子的电子层数等于主族叙述,W单质是一种常见的半导体材料.下列税法正确的是( )
| A. | R的气态氢化物比W的气态氢化物更稳定 | |
| B. | Z的氧化物能与盐酸反应,不能与NaOH溶液反应 | |
| C. | 原子半径按X、R、W、Z、Y的顺序依次增大 | |
| D. | X、Y、Z的最高化合价数值均等于其主族序数 |
11.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
15.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 44g CO2含有的原子数目为NA | |
| B. | 常温常压下,22.4L CCl4含有的分子数目为NA | |
| C. | 32gCu与足量浓硝酸充分反应,转移电子数目为NA | |
| D. | 1mol•L-1CuSO4溶液中含有的硫酸根离子数目为NA |
16.3He可以作为核聚变材料,以下关于3He的说法正确的是( )
| A. | 比4He少一个质子 | B. | 比4He多一个中子 | ||
| C. | 是4He的同素异形体 | D. | 是4He的同位素 |