题目内容
13.以下事实不能用元素周期律解释的是( )| A. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| B. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| C. | 氯与钠形成离子键,氯与硅形成共价键 | |
| D. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 |
分析 A.非金属性越强,与氢气化合越容易;
B.非金属性越强,氢化物越稳定;
C.氯最外层7个电子,容易得到,Na最外层1个电子,容易失去,Si不易失去也不易得到;
D.二氧化氮转化为四氧化二氮是放热反应,与元素周期律无关.
解答 解:A.非金属性F>I,故氟气与氢气化合较容易,可以利用元素周期律解释,故A正确;
B.氢化物稳定性:H2O>H2S,能用元素周期律解释,故B正确;
C.氯最外层7个电子,容易得到,Na最外层1个电子,容易失去,Si不易失去也不易得到,所以钠与硅与氯气形成的化合物不同,可以利用元素周期律解释,故C正确;
D.二氧化氮转化为为四氧化二氮是放热反应,升高温度,平衡左移,即二氧化氮浓度增大,与元素周期律无关,故D错误,
故选D.
点评 本题考查物质的性质及元素周期律,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
4.用如图所示装置能达到有关实验目的是( )
| A. | 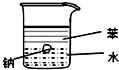 证明密度ρ(苯)<ρ(钠)<ρ(水) | B. | 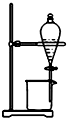 分离酒精和四氯化碳 | ||
| C. | 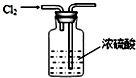 干燥Cl2 | D. | 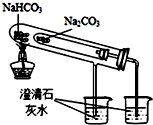 比较NaHCO3和Na2CO3的热稳定性 |
8.下列叙述错误的是( )
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| D. | 乙烯、甲烷都不能使溴的四氯化碳溶液和酸性KmnO4溶液褪色 |
18.“轻轨电车”是近年新兴的一种交通工具.电车开动时,在电车与架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该具有耐高温、能导电的性质.对于该接触点上的材料选择,你认为较合适的是( )
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
5.下表为元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.据此,下列说法中错误的是( )
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
2.下列有关物质用途的说法中,不正确的是( )
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |


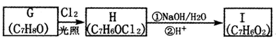
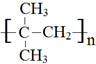 .
.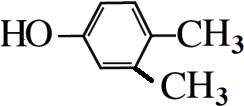 .
.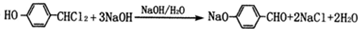 .
. .
.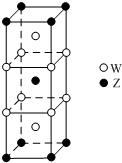 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.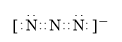 .
.