题目内容
CO和CO2混合气体含碳元素36%,取此混合气体10g,通过足量灼热的CuO后,将气体通过足量的澄清石灰水,得到白色沉淀的质量是( )
| A、5g | B、10g |
| C、20g | D、30g |
考点:有关混合物反应的计算
专题:计算题
分析:混合气体通过足量灼热的CuO后,得到气体为二氧化碳,混合物中碳元素都转化到二氧化碳中,根据碳元素质量分数计算混合物中碳元素质量,进而计算二氧化碳总物质的量,二氧化碳被石灰水吸收生成CaCO3,由碳元素守恒可知n(CaCO3)=n(CO2),再根据m=nM计算m(CaCO3).
解答:
解:混合物中碳元素质量为10g×36%=3.6g,其物质的量为
=0.3mol,
混合气体通过足量灼热的CuO后,得到气体为二氧化碳,混合物中碳元素都转化到二氧化碳中,根据碳元素守恒,可知二氧化碳总物质的量为0.3mol,二氧化碳被石灰水吸收生成CaCO3,由碳元素守恒可知n(CaCO3)=n(CO2)=0.3mol,故m(CaCO3)=0.3mol×100g/mol=30g,
故选D.
| 3.6g |
| 12g/mol |
混合气体通过足量灼热的CuO后,得到气体为二氧化碳,混合物中碳元素都转化到二氧化碳中,根据碳元素守恒,可知二氧化碳总物质的量为0.3mol,二氧化碳被石灰水吸收生成CaCO3,由碳元素守恒可知n(CaCO3)=n(CO2)=0.3mol,故m(CaCO3)=0.3mol×100g/mol=30g,
故选D.
点评:本题考查混合物计算,侧重考查学生分析解决问题的能力,注意利用碳元素守恒进行解答,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、纯碱、烧碱均属碱 |
| B、CO、SO2均属酸性氧化物 |
| C、凡能电离出H+的化合物均属酸 |
| D、盐类物质一定含有金属离子或铵根离子 |
有一铁粉和氧化铜的混合物6.96g,进行如下实验:
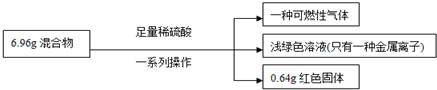
根据实验所得数据,关于混合物相关说法正确的是( )

根据实验所得数据,关于混合物相关说法正确的是( )
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
在铁制品上镀上一定厚度的银层,以下设计方案正确的是( )
| A、银用阴极,镀件作阳极,溶液中含有银离子 |
| B、铂作阴极,镀件作阳极,溶液中含有银离子 |
| C、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D、银作阳极,镀件作阴极,溶液中含有银离子 |
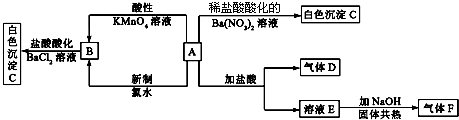

 某混合溶液中,只可能大量含有下表所列离子中的某几种:
某混合溶液中,只可能大量含有下表所列离子中的某几种: