题目内容
在密闭容器中,对于反应:N2(g)+3H2(g)?2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%.若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和它的转化率,正确的是( )
| A、20mol;70% |
| B、20mol;30% |
| C、40mol;35% |
| D、10mol;50% |
考点:化学平衡的计算
专题:化学平衡专题
分析:从氨气开始进行化学反应,平衡时各组分的含量相同,二者为等效平衡:
若为恒温恒容,按化学计量数转化到左边满足n(N2)=10mol、n(H2)=30mol即可,根据原平衡时氢气转化率计算原平衡体系中氢气的物质的量,据此计算参加反应的氨气的物质的量,再根据转化率定义计算;
若为恒温恒压,按化学计量数转化到左边满足n(N2):n(H2)=10mol:30mol=1:3即可,n(N2):n(H2)=1:3等于化学计量数之比,故氨气的物质的量为任意值,氨气的转化率与恒温恒容条件下相同.
若为恒温恒容,按化学计量数转化到左边满足n(N2)=10mol、n(H2)=30mol即可,根据原平衡时氢气转化率计算原平衡体系中氢气的物质的量,据此计算参加反应的氨气的物质的量,再根据转化率定义计算;
若为恒温恒压,按化学计量数转化到左边满足n(N2):n(H2)=10mol:30mol=1:3即可,n(N2):n(H2)=1:3等于化学计量数之比,故氨气的物质的量为任意值,氨气的转化率与恒温恒容条件下相同.
解答:
解:从氨气开始进行化学反应,平衡时各组分的含量相同,二者为等效平衡:
若为恒温恒容,按化学计量数转化到左边满足n(N2)=10mol、n(H2)=30mol,氮气与氢气的物质的量之比等于化学计量数之比,由方程式可知n(NH3)=2n(N2)=2×10mol=20mol,
原平衡时氮气转化率为30%,则原平衡体系中氮气的物质的量为10mol×(1-30%)=7mol,故从氨气建立平衡生成的氮气为7mol,由方程式可知,参加反应的氨气的物质的量为7mol×2=14mol,故从氨气建立等效平衡,氨气的转化率为:
×100%=70%;
若为恒温恒压,按化学计量数转化到左边满足n(N2):n(H2)=10mol:30mol=1:3即可,n(N2):n(H2)=1:3等于化学计量数之比,故氨气的物质的量为任意值,氨气的转化率为70%,
故选A.
若为恒温恒容,按化学计量数转化到左边满足n(N2)=10mol、n(H2)=30mol,氮气与氢气的物质的量之比等于化学计量数之比,由方程式可知n(NH3)=2n(N2)=2×10mol=20mol,
原平衡时氮气转化率为30%,则原平衡体系中氮气的物质的量为10mol×(1-30%)=7mol,故从氨气建立平衡生成的氮气为7mol,由方程式可知,参加反应的氨气的物质的量为7mol×2=14mol,故从氨气建立等效平衡,氨气的转化率为:
| 14mol |
| 2mol |
若为恒温恒压,按化学计量数转化到左边满足n(N2):n(H2)=10mol:30mol=1:3即可,n(N2):n(H2)=1:3等于化学计量数之比,故氨气的物质的量为任意值,氨气的转化率为70%,
故选A.
点评:本题考查等效平衡的有关计算,难度中等,注意理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比,2:恒温恒压,按化学计量数转化一边,对应物质满足等比.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列物质中,属于碱的是( )
| A、CO2 |
| B、HCl |
| C、NaCl |
| D、KOH |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量可能为9.6g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH溶液体积为150mL |
| D、溶解合金时产生NO气体体积2.24L(STP) |
有一铁粉和氧化铜的混合物6.96g,进行如下实验:
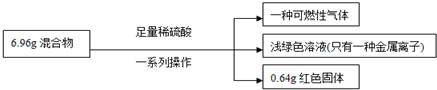
根据实验所得数据,关于混合物相关说法正确的是( )

根据实验所得数据,关于混合物相关说法正确的是( )
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A、镀锌层破损后即对铁制品失去保护作用 |
| B、未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程 |
| C、电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
在铁制品上镀上一定厚度的银层,以下设计方案正确的是( )
| A、银用阴极,镀件作阳极,溶液中含有银离子 |
| B、铂作阴极,镀件作阳极,溶液中含有银离子 |
| C、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D、银作阳极,镀件作阴极,溶液中含有银离子 |
将29.5g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重7g,则混合气体中乙烯的体积分数是( )
| A、75% | B、50% |
| C、30% | D、25% |

