题目内容
有两种金属粉未的混合物26g,投入足量的稀硫酸中充分反应,产生11.2L标准状况时的氢气,此混合物可能是( )
| A、Fe和Zn |
| B、Al和Zn |
| C、Mg和Al |
| D、Fe和Cu |
考点:有关混合物反应的计算
专题:极端假设法
分析:本题可以用平均值法进行分析解答,根据常见的金属的化合价,可以设该混合物为+2价金属混合物,且为能够和稀硫酸反应的金属,通过计算求出平均相对原子质量,然后分析所给选项得出答案.
解答:
解:标准状况下11.2L氢气的物质的量为:
=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均摩尔质量为:
=52g/mol,
A.Fe的相对原子质量为56,Zn的相对原子质量为65,二者的平均摩尔质量一定大于52g/mol,故A错误;
B.当Al的化合价为+2价时,可看成其相对原子质量为:
×27=18,Zn的相对原子质量为65,二者的平均摩尔质量可以为52g/mol,故B正确;
C.Mg的相对原子质量为24,Al的化合价为+2价时,可看成其相对原子质量为:
×27=18,二者的平均摩尔质量一定小于52g/mol,故C错误;
D.Fe的摩尔质量为56g/mol>52g/mol,铜不与稀硫酸反应,26g金属混合物与稀硫酸反应生成的氢气一定小于0.5mol,故D错误;
故选B.
| 11.2L |
| 22.4L/mol |
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均摩尔质量为:
| 26g |
| 0.5mol |
A.Fe的相对原子质量为56,Zn的相对原子质量为65,二者的平均摩尔质量一定大于52g/mol,故A错误;
B.当Al的化合价为+2价时,可看成其相对原子质量为:
| 2 |
| 3 |
C.Mg的相对原子质量为24,Al的化合价为+2价时,可看成其相对原子质量为:
| 2 |
| 3 |
D.Fe的摩尔质量为56g/mol>52g/mol,铜不与稀硫酸反应,26g金属混合物与稀硫酸反应生成的氢气一定小于0.5mol,故D错误;
故选B.
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法即可快速解答,注意化合价与相对原子质量的转化方法,如铝为+2价时摩尔质量为18g/mol.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、同一周期中,碱金属元素的第一电离能最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、若X原子2p轨道上有一个空轨道,Y原子3p轨道上只有一个空轨道,则它们一定同主族 |
| D、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子则它们一定同主族 |
有一铁粉和氧化铜的混合物6.96g,进行如下实验:
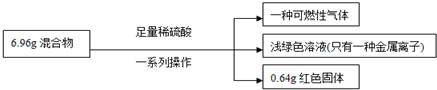
根据实验所得数据,关于混合物相关说法正确的是( )

根据实验所得数据,关于混合物相关说法正确的是( )
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
在铁制品上镀上一定厚度的银层,以下设计方案正确的是( )
| A、银用阴极,镀件作阳极,溶液中含有银离子 |
| B、铂作阴极,镀件作阳极,溶液中含有银离子 |
| C、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D、银作阳极,镀件作阴极,溶液中含有银离子 |
将29.5g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重7g,则混合气体中乙烯的体积分数是( )
| A、75% | B、50% |
| C、30% | D、25% |
某同学欲在铜钥匙上镀锌,有关说法正确的是( )
| A、用铜钥匙做阳极,碳棒做阴极,CuSO4溶液做电解质溶液 |
| B、Zn与铜钥匙用导线相连插入ZnSO4溶液中 |
| C、Zn做阳极,铜钥匙做阴极,ZnSO4溶液做电镀液电解 |
| D、在电镀过程中溶液中的Zn2+浓度减小,Cu2+浓度增大 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2 |
| B、氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
| C、高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 |
| D、SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |

 某混合溶液中,只可能大量含有下表所列离子中的某几种:
某混合溶液中,只可能大量含有下表所列离子中的某几种: