题目内容
16.在标准状况下,将1mol A气体发生如下反应:2A(g)?B(g)+xC(g),达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46g,密度为1.772g/L,试计算:(1)达平衡后,混合气的平均相对分子质量.
(2)达平衡后,A的转化率.
(3)C气体的化学计量数x的数值.
分析 达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46g,密度为1.772g/L,混合气体的物质的量为$\frac{\frac{46g}{1.772g/L}}{22.4L/mol}$=1.16mol,设转化的A为n,则
2A(g)?B(g)+xC(g)
开始 1 0 0
转化 n 0.5n $\frac{x}{2}$n
平衡 1-n 0.5n $\frac{x}{2}$n
(1-n)+0.5n+$\frac{x}{2}$n=1.16①
$\frac{1-n}{1.16}$×100%=58.6%②
联立①②,解得n=0.32,x=2,以此来解答.
解答 解:(1)混合气的总质量为46g,密度为1.772g/L,混合气体的物质的量为$\frac{\frac{46g}{1.772g/L}}{22.4L/mol}$=1.16mol,混合气的平均相对分子质量为$\frac{46}{1.16}$=39.6,
答:混合气的平均相对分子质量为39.6;
(2)设转化的A为n,则
2A(g)?B(g)+xC(g)
开始 1 0 0
转化 n 0.5n $\frac{x}{2}$n
平衡 1-n 0.5n $\frac{x}{2}$n
$\frac{1-n}{1.16}$×100%=58.6%,解得n=0.32mol,
则达平衡后,A的转化率为$\frac{0.32mol}{1mol}$×100%=32%,
答:达平衡后,A的转化率为32%;
(3)(1-n)+0.5n+$\frac{x}{2}$n=1.16,n=0.32,解得x=2,
答:C气体的化学计量数x的数值为2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算为解答的关键,侧重分析与应用能力的考查,注意物质的量的相关计算及应用,题目难度不大.

| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1 中,反应在10min~20min 内A平均速率为0.03 mol/(L•min)
(2)在实验 2 中,A 的初始浓度 C2为2.0 mol/L,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
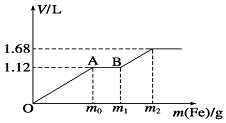 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
 .
.