题目内容
5.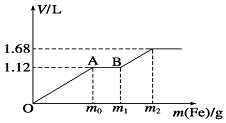 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
分析 因氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,以此解答该题.
解答 解:已知氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,
A.开始时产生的气体为NO,B中产生氢气,混合气体总体积为1.68L,n(H2)=$\frac{1.68L-1.12L}{22.4L/mol}$=0.025mol,故A错误;
B.AB段离子反应为Fe+2Fe3+═3Fe2+,故B错误;
C.n(NO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则所用混合溶液中c(HNO3)=$\frac{0.05mol}{0.1L}$=0.5mol/L,由OA段反应可知消耗氢离子为0.05mol×4=0.2mol,生成氢气消耗的氢离子为0.025mol×2=0.05mol,则n(H2SO4)=$\frac{0.2mol+0.05mol-0.05mol}{2}$=0.1mol,则c(H2SO4)=$\frac{0.1mol}{0.1L}$=1.0 mol•L-1,故C正确;
D.最终生成Fe2+,根据氧化还原反应中得失电子数目相等可知3×n(NO)+2×n(H2)=2n(Fe),即3×0.05mol+2×0.025mol=2n(Fe),n(Fe)=0.1mol,反应后溶液中Fe2+的物质的量为0.1mol,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意反应的先后顺序,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“下进上出” | |
| C. | 盛放NaOH溶液时,使用带橡胶塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度比水大 |
| 甲 | 乙 |  | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
CO2(g)+C(s)═2CO(g)△H1
CO(g)+$\frac{1}{2}$O2(s)═CO2(g)△H2
C(s)+O2(g)═CO2(g)△H3
CuO(s)+CO(g)═Cu(s)+CO2(g)△H4
2CuO(s)+C(s)═2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0 | B. | △H2>0 | C. | △H1=△H3-2△H2 | D. | 2△H4>△H5 |
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
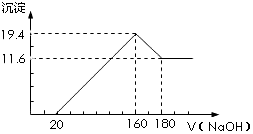 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: