题目内容
10.下列依据相关实验得出的结论正确的是( )| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
分析 A.二氧化硫通入澄清石灰水也会变浑浊;
B.焰色反应为元素的性质;
C.滴加氯水后溶液显红色,说明生成Fe3+,由Fe2+氧化生成;
D.溴水中溴单质是强氧化剂,通入的气体只要是还原性气体都可以使溴水褪色.
解答 解:A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液可能是碳酸盐溶液或碳酸氢盐溶液或亚硫酸盐溶液,故A错误;
B.焰色反应为元素的性质,此溶液可能是NaOH,NaOH为碱,不是盐,故B错误;
C.向某溶液中滴加KSCN 溶液,溶液不变色,说明不含铁离子,滴加氯水后溶液显红色,氯气氧化亚铁离子为铁离子,遇到硫氰酸钾溶液生成血红色溶液证明该溶液中一定含Fe2+,故C正确;
D.将某气体通入溴水中,溴水颜色褪去,通入的气体只要是还原性气体或能发生加成的有机气体都可以使溴水褪色,如乙烯、硫化氢等,该气体不一定是二氧化硫,故D错误.
故选C.
点评 本题考查物质检验和鉴别,为高频考点,侧重常见离子检验及物质检验的考查,把握检验试剂、现象、物质的性质为解答的关键,注意检验中应排除其它离子或物质的干扰,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
20.下列图象能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol)( )
| A. |  n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. |  n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. |  n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. |  n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
1.某学习小组用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备Fe3O4纳米材料的流程示意图如下: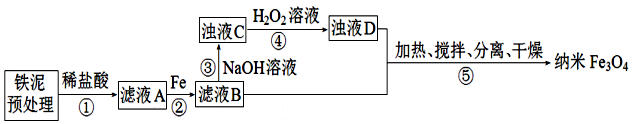
已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)的关系如图所示.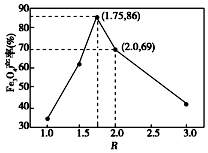
(1)为提高步骤①的反应速率,可采取的措施是搅拌、适当升高温度.
(2)步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+.
(3)常温下Fe3+、Fe2+以氢氧化物形式完全沉淀时溶液的pH如图.该温度下Ksp[Fe(OH)3]=1.0×10-38
(4)浊液D中铁元素以FeOOH形式存在.步骤④中,反应的化学方程式是2Fe(OH)2+H2O2=2FeOOH+2H2O;
步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素
(5)⑤反应的离子方程式为2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O;步骤⑤中的“分离”包含的步骤有过滤、洗涤.
(6)设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b.为使Fe3O4的产率最高,则$\frac{a}{b}$=0.636.(填数值,小数点后保留3位)

已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)的关系如图所示.

(1)为提高步骤①的反应速率,可采取的措施是搅拌、适当升高温度.
(2)步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+.
(3)常温下Fe3+、Fe2+以氢氧化物形式完全沉淀时溶液的pH如图.该温度下Ksp[Fe(OH)3]=1.0×10-38
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素
(5)⑤反应的离子方程式为2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O;步骤⑤中的“分离”包含的步骤有过滤、洗涤.
(6)设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b.为使Fe3O4的产率最高,则$\frac{a}{b}$=0.636.(填数值,小数点后保留3位)
18.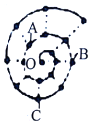 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )| A. | O与A、B、C均能形成两种化合物 | |
| B. | A元素位于元素周期表ⅥA族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | B、C最高价氧化物的水化物可以相互反应 |
5.2SO2(g)+O2(g)?SO3(g)是制备硫酸的重要反应,下列叙述中正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 不论以何种方式使反应体系的压强增大,化学反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应到达平衡的时间 | |
| D. | 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中 |
15.下列有关化学用语表达不正确的是( )
| A. | Na的原子结构示意图: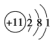 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: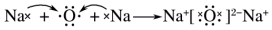 |
2.在一密闭容器中进行反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
19.下列叙述不正确的是( )
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |