题目内容
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 500mL0.l mol/LFeCl3溶液中含Fe3+0.05NA | |
| B. | 常温常压下,2.24L氯气溶于NaOH溶液中,转移电子数为0.lNA | |
| C. | 常温常压下,28g乙烯中所含C-H键的数目为4NA | |
| D. | 0.5 mol锌与浓硫酸完全反应生成SO2和H2的混合气体(不考虑气体溶解),气体的分子总数小于0.5NA |
分析 A、Fe3+为弱碱阳离子,在溶液中水解;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出乙烯的物质的量,然后根据乙烯中含4条C-H键来分析;
D、锌反应后变为+2价,而由浓硫酸反应生成二氧化硫和氢气时,每生成1mol二氧化硫或1mol氢气均得到2mol电子.
解答 解:A、Fe3+为弱碱阳离子,在溶液中水解,导致个数减少,故溶液中的铁离子的个数小于0.05NA个,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L氯气的物质的量小于0.1mol,则转移的电子数小于0.1NA个,故B错误;
C、28g乙烯的物质的量为1mol,而乙烯中含4条C-H键,故1mol乙烯中含4NA条C-H键,故C正确;
D、锌反应后变为+2价,故0.5mol锌反应有失去1mol电子.而由浓硫酸反应生成二氧化硫和氢气时,每生成1mol二氧化硫或1mol氢气均得到2mol电子,由于锌失去的电子的物质的量为1mol,故得到的二氧化硫和氢气混合气体的物质的量为0.5mol,故分子个数之和为0.5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
6.下列说法中正确的是( )
| A. | SO3与SO2分子空间结构不同,分子中S原子杂化方式也不同 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB2型的分子空间构型必为直线形 |
2.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
19.对如图两种化合物的结构或性质描述错误的是( )
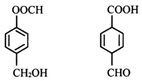

| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
6.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射微蓝色透明液体,有光亮的通路 | 微蓝色透明液体为胶体 |
| B | 室温下,向10mL 0.2mol•L-1 AgNO3溶液中滴入2滴0.1 mol•L-1 NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1NaI溶液,生成黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入BaCl2溶液,无明显现象,再加稀盐酸,有无色且能使澄清石灰水变浑浊的气体产生 | 溶液中一定含HCO3- |
| D | 取少量CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,无淡黄色沉淀出现 | CH3CH2Br没有水解 |
| A. | A | B. | B | C. | C | D. | D |
16.在给定的条件下,下列选项所示的物质间转化均能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | ||
| C. | NaCl(aq)$\stackrel{电解}{→}$Cl2$→_{△}^{过量Fe}$FeCl2(s) | D. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
3.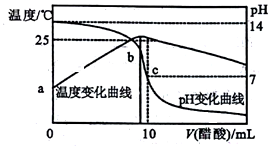 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | 水的电离程度:c>b | B. | a点Kw比b点大 | ||
| C. | n>1.0 | D. | c点:Ka(CH3COOH)=$\frac{10}{10n+1}$×10-8 |
20.利用实验器材(规格和数量不限),能够完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| B | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| C | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL 0.1mol•L-1的稀盐酸溶液 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用出H2SO4标准液滴定未知浓度的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.25℃时,下列有关电解质溶液的说法正确的是( )
| A. | 将Na2CO3溶液用水稀释后,pH变大,Kw不变 | |
| B. | 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变 | |
| C. | pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH) | |
| D. | 分别用pH=2和pH=3的CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va>Vb |