题目内容
20.利用实验器材(规格和数量不限),能够完成相应实验的一项是( )| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| B | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| C | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL 0.1mol•L-1的稀盐酸溶液 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用出H2SO4标准液滴定未知浓度的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.中和热测定中必须使用环形玻璃搅拌棒;
B.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,且能够中和乙酸、吸收乙醇;
C.配制一定浓度的溶液时,必须使用胶头滴管定容;
D.中和滴定中,待测液需要盛放在锥形瓶中,且缺少指示剂.
解答 解:A.中和热的测定实验中,除了使用量筒、温度计、烧杯、碎纸条、盖板外,还缺少环形玻璃搅拌棒,故A错误;
B.碳酸钠溶液能够中和乙酸、吸收乙醇,且混合液分层,可用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇,且用到主要仪器为烧杯、分液漏斗,故B正确;
C.用浓盐酸配制100mL 0.1mol•L-1的稀盐酸溶液,除了使用量筒、玻璃捧、烧杯、100mL容量瓶外,还必须使用胶头滴管,故C错误;
D.用出H2SO4标准液滴定未知浓度的NaOH溶液,必须使用酚酞做指示剂,且缺少锥形瓶,无法完成实验,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度不大,涉及中和热测定、中和滴定、溶液配制、物质分离与提纯等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
15.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 500mL0.l mol/LFeCl3溶液中含Fe3+0.05NA | |
| B. | 常温常压下,2.24L氯气溶于NaOH溶液中,转移电子数为0.lNA | |
| C. | 常温常压下,28g乙烯中所含C-H键的数目为4NA | |
| D. | 0.5 mol锌与浓硫酸完全反应生成SO2和H2的混合气体(不考虑气体溶解),气体的分子总数小于0.5NA |
8.利用如图所示的装置可将CO2转化为燃料甲醇,下列说法正确的是( )


| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |
15.下列各组中的物质均能发生加成反应的是( )
| A. | 乙烷和乙烯 | B. | 乙酸和四氯化碳 | C. | 苯和聚乙烯 | D. | 丙烯和乙炔 |
5.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H;下表所列数据是该反应在不同温度下的化学平衡常数(K).
①写出该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$.
②下列措施可以加快反应速率且能提高CO转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出c.增大压强 d.加入催化剂 e.降低温度
③在300℃时,将2molCO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将向正反应方向进行 (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”).
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O.
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01mol•L-1(25℃下测定),则理论上消耗氧气的体积为56mL(标况下).
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H;下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②下列措施可以加快反应速率且能提高CO转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出c.增大压强 d.加入催化剂 e.降低温度
③在300℃时,将2molCO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将向正反应方向进行 (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”).
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O.
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01mol•L-1(25℃下测定),则理论上消耗氧气的体积为56mL(标况下).
12.下列有关物质的性质与用途都正确且具有对应关系的是( )
| A. | NH4HCO3受热易分解,可用作氮肥 | |
| B. | Na2CO3具有碱性,可用作胃酸中和剂 | |
| C. | SiO2易传导光信号,可用作光导纤维 | |
| D. | Ca(ClO)2在空气中不稳定,可用于漂白纸张 |
1.不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.下面是某些短周期元素的X值.
(1)通过分析X值的变化规律,确定N、Mg的X值范围:0.93<X(Mg)<1.57;2.55<X(N)<3.44.
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为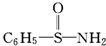 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为
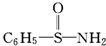 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA | |
| B. | 1L0.1mol•L-1碳酸钠溶液中含有的氧原子数为0.3NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA |