题目内容
 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.(1)利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式
(2)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
①常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-)
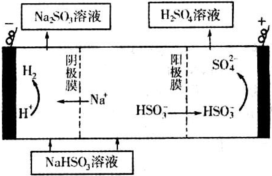
②然后电解该NaHSO3溶液可制得硫酸.电解原理示意图如下图所示.请写出开始时阳极反应的电极反应式
考点:二氧化硫的污染及治理,化学电源新型电池,离子浓度大小的比较
专题:
分析:(1)依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
(2)①根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
②根据化合价变化判断阳极反应物质,写出阳极反应式.
(2)①根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
②根据化合价变化判断阳极反应物质,写出阳极反应式.
解答:
解:(1)该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(2)①A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(2)①A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评:本题考查了原电池原理和电解原理的应用,注意电极反应的书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
将11.2g的MgCu混合物完全溶解于足量的硝酸中,收集反应产生的X气体.再向所得溶液中加入适量的氢氧化钠溶液,产生21.4g沉淀.根据题意推断气体X的成分可能是( )
| A、0.3 mol NO2和0.3 mol NO |
| B、0.1 mol NO、0.2 mol NO2和0.05 mol N2O4 |
| C、0.2 mol NO2和0.1 mol N2O4 |
| D、0.6 mol NO |
碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃(不考虑反异构和立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列叙述正确的是( )
| A、合金材料中不可能含有非金属元素 |
| B、SiO2为酸性氧化物,故不能与任何酸发生化学反应 |
| C、用砂纸打磨过的铝箔放在洒精灯焰上不燃烧,说明铝不易与O2反应 |
| D、FeCl2、FeCl3、Fe(OH)3三种物质都可以直接通过化合反应制取 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为( )
| A、v (O2)=0.0l mol?L-1?s-1 |
| B、v (NO)=0.001 mol?L-1?s-1 |
| C、v (NH3)=0.001 mol?L-1?s-1 |
| D、v (H2O)=0.003 mol?L-1?s-1 |