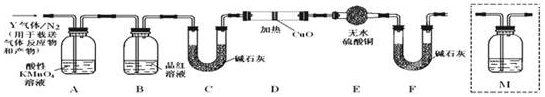
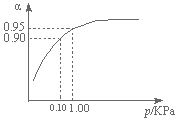
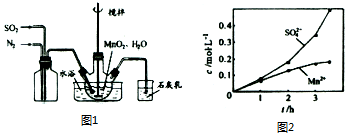
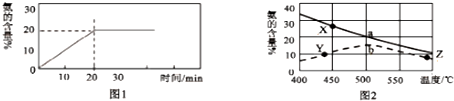
题目内容
8.已知C3N4晶体具有比金刚石还大的硬度,且原子间均以单键结合.下列关于C3N4 晶体的说法正确的是( )| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
分析 C3N4晶体具有比金刚石还大的硬度,且原子间均以单键结合,可知为原子晶体,只存在C-N共价键,空间为网状结构,结合原子半径可比较共价键的键长,以此来解答.
解答 解:A.因硬度比金刚石大,则C3N4 晶体是原子晶体,故A错误;
B.C3N4 晶体中原子间均以单键结合,不存在离子键,故B错误;
C.C的原子半径大于N的原子半径,则C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要短,故C错误;
D.C原子周围有4个单电子,N原子周围有3个单电子,则C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子,且原子间均以单键结合,形成空间网状结构,故D正确;
故选D.
点评 本题考查晶体及化学键,为高频考点,把握习题中的信息、晶体类型、晶体中作用力为解答的关键,侧重分析与应用能力的考查,注意化学键的判断,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
18.KMnO4与H2C2O4反应,生成Mn2+和CO2,酸性条件下,用0.100mol•L-1KMnO4标准溶液滴定20.00mLH2C2O4溶液,达到滴定终点时,消耗16.00mL标准溶液,则H2C2O4溶液的浓度为( )
| A. | 0.400mol•L-1 | B. | 0.300mol•L-1 | C. | 0.200mol•L-1 | D. | 0.100mol•L-1 |
16.现使用酸碱中和滴定法测定市售白醋的总酸量(g•100ml-1).
Ⅰ.实验步骤:
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到容量瓶 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=$\frac{(15.95+15.00+15.05+14.95)}{4}$mL=15.24mL.指出他的计算的不合理之处:第1次滴定误差明显大,属异常值,应舍去.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的a(填写序号)
a.电离常数 b.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)ab.
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
Ⅰ.实验步骤:
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到容量瓶 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=$\frac{(15.95+15.00+15.05+14.95)}{4}$mL=15.24mL.指出他的计算的不合理之处:第1次滴定误差明显大,属异常值,应舍去.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的a(填写序号)
a.电离常数 b.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)ab.
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
3.NaNO2是一种食品添加剂,它与酸性KMnO4溶液发生反应 MnO4-+NO2-+X→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
13.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率.现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
17.下列过程一定涉及氧化还原反应的是( )
| A. | 萃取 | B. | 电解 | C. | 净水 | D. | 分馏 |