题目内容
20.高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: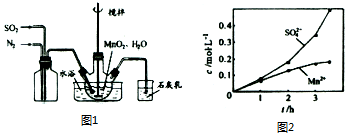
(1)制备MnSO4溶液:在烧瓶中(装置见图1)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3═MnSO4+H2O).
请回答:①石灰乳参与反应的化学方程式为SO2+Ca(OH)2=CaSO3+H2O.
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有控制适当的温度、缓慢通入混合气体.
③若实验中将N2换成空气,测得反应液中Mn2+、SO2-4的浓度随反应时间t变化如图2.导致溶液中Mn2-、SO2-4'浓度变化产生明显差异的原因是Mn2+催化氧气与亚硫酸反应生成硫酸.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤顺序如下:
A.边搅拌边加入NaHCO3(Na2CO3),并控制溶液PH<7.7
B.过滤,用少量水洗涤2~3次.
C.检验SO2-4是否被洗涤除去
D.用少量C2H5OH洗涤
E.低于100℃干燥.
请回答:①A步骤中控制溶液PH<7.7的原因可能是Mn2++2OH-=Mn(OH)2↓(用离子方程式表示)
②C步骤中如何检验SO2-已经被洗涤除去:取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格.
③D步骤中用少量C2H5OH洗涤的原因可能是:乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解.
分析 (1)①根据题中所示的石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,据此回答;
②根据实验的操作原则,为了让气体尽可能转化,要根据反应所需的条件和用量严格操作;
③考虑氮气的化学性质稳定,空气中氧气的活泼性等因素的影响;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应方程式为:SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
②为使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,故答案为:控制适当的温度;缓慢通入混合气体;
③氮气的化学性质稳定,空气中氧气性质活泼,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大,故答案为:Mn2+催化氧气与亚硫酸反应生成硫酸;
(2)①因为Mn(OH)2开始沉淀时pH=7.7,所以A步骤中控制溶液PH<7.7的原因可能是防止生成Mn(OH)2沉淀,离子方程式为:Mn2++2OH-=Mn(OH)2↓,故答案为:Mn2++2OH-=Mn(OH)2↓;
②检验SO42-是否被洗涤干净,可以取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格,故答案为:取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格;
③用少量的乙醇洗涤,主要原因是乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解,故答案为:乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 标准状况下,22.4L氯气与足量氢氧化钠溶艘反应转移的电子数为2NA | |
| B. | 将含有1molFeCl3的饱和溶液加入到沸水中得到氢氧化铁胶体,其中胶体粒子的数目为NA | |
| C. | 两份2.7g铝分别与100 mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 通常情况下,16g CH4中含有4NA个C-H键 |
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
| A. | 水晶、玛瑙、红宝石、蓝宝石的主要成分都是非金属氧化物 | |
| B. | 蛋白质是结构复杂的高分子化合物,蛋白质的生物活性首先取决于蛋白质的一级结构 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一,红外光谱法可用于研究有机物分子结构,滴定法不能用于测量盐类物质溶液的浓度 | |
| D. | 丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象 |
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 12g由${\;}_{6}^{12}$C60和${\;}_{6}^{14}$C60组成的固体中的原子数为NA | |
| B. | 4.4g由CO2和N2O组成的混合气体中的电子数为2.2NA | |
| C. | 常温常压下22.4LNH3中所含的共价键数为3NA | |
| D. | 1L1mol•L-1次氯酸溶液中的ClO-数为NA |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)300℃时.2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
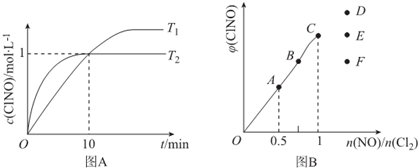
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol/(L•min),
③T2时该反应的平衡常数K=2
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
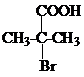 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$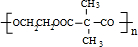 +2nH2O.
+2nH2O.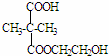 ,②分子内含有一个七元环
,②分子内含有一个七元环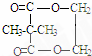 .
.