题目内容
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应 ③CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.1kJ?mol-1
二甲醚合成反应 ④2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 .
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 .
a.容器中气体平均相对分子质量保持不变 b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变 d.CH3OH(g)的消耗速率等于H2(g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 .
a.CH3OH(g)的平衡转化率减小 b.CH3OCH3(g)的体积分数增大
c.H2O(g)浓度为0.5mol?L-1 d.容器中的压强变为原来的1.25倍
(4)二甲醚-氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚-氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol.
①CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应 ③CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.1kJ?mol-1
二甲醚合成反应 ④2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是
a.容器中气体平均相对分子质量保持不变 b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变 d.CH3OH(g)的消耗速率等于H2(g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为
a.CH3OH(g)的平衡转化率减小 b.CH3OCH3(g)的体积分数增大
c.H2O(g)浓度为0.5mol?L-1 d.容器中的压强变为原来的1.25倍
(4)二甲醚-氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚-氧气燃料电池的负极反应为
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡状态的判断,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
(3)根据放出49kJ热量结合热化学方程式求解CH3OH(g)的平衡转化率,平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;根据平衡移动的影响判断移动方向,反应达到平衡时,正逆反应速率相等,各物质的浓度不再发生改变,由此衍生的一些物理量也不再发生变化;
(4)燃料电池中燃料在负极上失电子发生氧化反应,书写电极反应,计算电子转移数.
(2)达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
(3)根据放出49kJ热量结合热化学方程式求解CH3OH(g)的平衡转化率,平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;根据平衡移动的影响判断移动方向,反应达到平衡时,正逆反应速率相等,各物质的浓度不再发生改变,由此衍生的一些物理量也不再发生变化;
(4)燃料电池中燃料在负极上失电子发生氧化反应,书写电极反应,计算电子转移数.
解答:
解:(1)①CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
④2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律①×2+④得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1;
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ?mol-1;
(2)CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
a.由于该反应是体积减小的反应,在反应到达平衡的过程中,容器中气体平均相对分子质量保持不变,能判断反应是否处于平衡状态,故a正确;
b.由于该反应在恒容条件下进行,反应前后气体的质量不变,容器的体积不变,所以密度也守恒,容器中气体密度保持不变,不能判断反应是否处于平衡状态,故b错误;
c.反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,CH3OH(g)浓度保持不变,能判断反应是否处于平衡状态,故c正确;
d.CH3OH(g)的消耗速率为逆反应,H2(g)的消耗速率为正反应,两者相等,不能说明正逆反应速率相等,当CH3OH(g)的消耗速率与H2(g)的消耗速率比为1:2时正逆反应速率相等,故d错误;
故选ac;
(3)2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1,2mol甲醇反应放出24.5KJ的热量,反应过程中共放出49kJ热量,说明将8mol CH3OH(g)充入5L密闭容器中进行反应,有4mol甲醇已经转化,所以转化率为
×100%=50%,
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:1.6mol/L 0 0
转化:0.8mol/L 0.4mol/L 0.4mol/L
平衡:0.8mol/L 0.4mol/L 0.4mol/L
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,
则化学平衡常数为K=
=0.25;
该温度下,向容器中再充入2mol CH3OH(g),反应物浓度增大,平衡向正反应方向移动,温度不变,平衡常数不变,设甲醇转化了Xmol/L,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:2mol/L 0 0
转化:xmol/L
xmol/L
xmol/L
平衡:(2-x)mol/L
xmol/L
xmol/L
=0.25,解得:x=1,
a.CH3OH(g)的平衡转化率
×100%=50%不变,故a错误;
b.CH3OH(g)的平衡转化率不变,CH3OCH3(g)的体积分数也不变,故b错误;
c.H2O(g)浓度为
xmol/L=0.5mol?L-1,故c正确;
d.容器中的压强比为物质的量比,所以变为原来的
=1.25倍,故d正确;
故答案为:50%;0.25;cd;
(4)若电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+; 电解质为酸性,氧气在正极发生还原反应,O2+4H++4e-=2H2O,消耗2.8L(标准状况)氧气时,理论上流经外电路的电子为
×4=0.5mol,
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;0.5.
④2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律①×2+④得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1;
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ?mol-1;
(2)CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
a.由于该反应是体积减小的反应,在反应到达平衡的过程中,容器中气体平均相对分子质量保持不变,能判断反应是否处于平衡状态,故a正确;
b.由于该反应在恒容条件下进行,反应前后气体的质量不变,容器的体积不变,所以密度也守恒,容器中气体密度保持不变,不能判断反应是否处于平衡状态,故b错误;
c.反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,CH3OH(g)浓度保持不变,能判断反应是否处于平衡状态,故c正确;
d.CH3OH(g)的消耗速率为逆反应,H2(g)的消耗速率为正反应,两者相等,不能说明正逆反应速率相等,当CH3OH(g)的消耗速率与H2(g)的消耗速率比为1:2时正逆反应速率相等,故d错误;
故选ac;
(3)2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1,2mol甲醇反应放出24.5KJ的热量,反应过程中共放出49kJ热量,说明将8mol CH3OH(g)充入5L密闭容器中进行反应,有4mol甲醇已经转化,所以转化率为
| 4 |
| 8 |
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:1.6mol/L 0 0
转化:0.8mol/L 0.4mol/L 0.4mol/L
平衡:0.8mol/L 0.4mol/L 0.4mol/L
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,
则化学平衡常数为K=
| 0.4mol/L×0.4mol/L |
| (0.8mol/L)2 |
该温度下,向容器中再充入2mol CH3OH(g),反应物浓度增大,平衡向正反应方向移动,温度不变,平衡常数不变,设甲醇转化了Xmol/L,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:2mol/L 0 0
转化:xmol/L
| 1 |
| 2 |
| 1 |
| 2 |
平衡:(2-x)mol/L
| 1 |
| 2 |
| 1 |
| 2 |
| ||||
| (2-x)2 |
a.CH3OH(g)的平衡转化率
| 1mol/L |
| 2mol/L |
b.CH3OH(g)的平衡转化率不变,CH3OCH3(g)的体积分数也不变,故b错误;
c.H2O(g)浓度为
| 1 |
| 2 |
d.容器中的压强比为物质的量比,所以变为原来的
| (1mol/L+0.5mol/L+0.5mol/L)×5L |
| (0.8mol/L+0.4mol/L+0.4mol/L)×5L |
故答案为:50%;0.25;cd;
(4)若电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+; 电解质为酸性,氧气在正极发生还原反应,O2+4H++4e-=2H2O,消耗2.8L(标准状况)氧气时,理论上流经外电路的电子为
| 2.8L |
| 22.4L/mol |
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;0.5.
点评:本题考查了热化学方程式和盖斯定律的应用、化学平衡移动原理的分析判断、原电池原理分析和电极书写,掌握基础是关键,注意(3)三段式的求解,注意(4)电极反应式的书写,题目难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
 某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、b点时c(Ba2+)?c(SO42- )小于Ksp |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、加水稀释可以使溶液由b点变到c点 |
| D、加入适量的Na2SO4不可能使溶液由a点变到c点 |
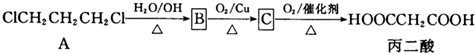
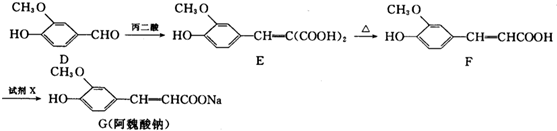
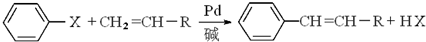 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)