题目内容
将饱和三氯化铁溶液滴入沸水时,液体变为 色,得到的分散系是 ,反应的化学方程式为 .用此分散系进行实验,将其装入U形管内,用石墨作电极,接通直流电源,通电一段时间后发现 极(填阴或阳)附近颜色逐渐变深,这表明 ,这种现象称为 .
考点:胶体的重要性质
专题:溶液和胶体专题
分析:将饱和的FeCl3溶液逐滴滴入沸水中,液体变为红褐色,得到的是Fe(OH)3胶体.发现阴极附近颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷.
解答:
解:将饱和的FeCl3溶液逐滴滴入沸水中,液体变为红褐色,得到的是Fe(OH)3胶体,化学方程式为FeCl3+3H2O=Fe(OH)3(胶体)+3HCl,阴极附近颜色逐渐变深,表明Fe(OH)3胶粒带正电荷,这种现象称为电泳,
故答案为:红褐;Fe(OH)3胶体;FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;阴;Fe(OH)3胶粒带正电荷;电泳.
故答案为:红褐;Fe(OH)3胶体;FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;阴;Fe(OH)3胶粒带正电荷;电泳.
点评:本题考查胶体的性质,难度不大,掌握胶体的制备是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设阿伏加德罗常数的值为NA,下列叙述正确的是( )
| A、常温常压下,含NA个氧分子的氧气的体积小于22.4L |
| B、2.24LCl2与足量Ca(OH)2反应,转移的电子数为0.1NA |
| C、1mol CH3OH在燃料电池负极反应时转移的电子数是6NA |
| D、100mL 18 mol/L浓硫酸与足量铜共热,可生成SO2的分子数为0.9NA |
能正确表示下列化学反应的离子方程式的是( )
| A、向碳酸氢铵溶液中加入过量的NaOH固体 NH4++OH-=NH3↑+H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
下列物质的水溶液能导电,但属于非电解质的是( )
| A、HCl |
| B、Cl2 |
| C、NaHCO3 |
| D、CO2 |
能说明NH4+的5个原子不在同一平面而为正四面体结构的是( )
| A、键长相同,两个键之间夹角为109°28′ |
| B、N-H键为极性共价键 |
| C、4个N-H键的键能、键长相同 |
| D、N-H原子间存在配位键 |
下列叙述中,正确的是( )
| A、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
| B、常温下,pH=4的溶液一定是酸溶液 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
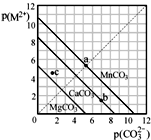 一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
| C、b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D、在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
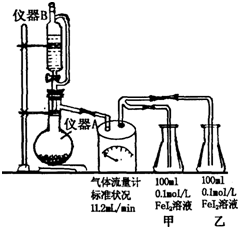 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题: