题目内容
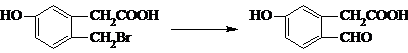
 某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、b点时c(Ba2+)?c(SO42- )小于Ksp |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、加水稀释可以使溶液由b点变到c点 |
| D、加入适量的Na2SO4不可能使溶液由a点变到c点 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A.b点表示Qc>Ksp,溶液过饱和;
B.Ksp只受温度的影响;
C.加入蒸馏水,c(SO42-)、c(Ba2+)均减小;
D.加入适量的Na2SO4,c(SO42-)增大,c(Ba2+)减小.
A.b点表示Qc>Ksp,溶液过饱和;
B.Ksp只受温度的影响;
C.加入蒸馏水,c(SO42-)、c(Ba2+)均减小;
D.加入适量的Na2SO4,c(SO42-)增大,c(Ba2+)减小.
解答:
解:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A.b点表示Qc>Ksp,溶液过饱和,有沉淀析出,故A错误;
B.Ksp只受温度的影响,a点对应的Ksp等于c点对应的Ksp,故B正确;
C.加入蒸馏水,c(SO42-)、c(Ba2+)均减小,不可能出现c(SO42-)不变,而c(Ba2+)减小的情况,故C错误;
D.加入适量的Na2SO4,c(SO42-)增大,c(Ba2+)减小,可能能使溶液由a点变到c点,故D错误.
故选B.
A.b点表示Qc>Ksp,溶液过饱和,有沉淀析出,故A错误;
B.Ksp只受温度的影响,a点对应的Ksp等于c点对应的Ksp,故B正确;
C.加入蒸馏水,c(SO42-)、c(Ba2+)均减小,不可能出现c(SO42-)不变,而c(Ba2+)减小的情况,故C错误;
D.加入适量的Na2SO4,c(SO42-)增大,c(Ba2+)减小,可能能使溶液由a点变到c点,故D错误.
故选B.
点评:本题考查沉淀溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.

练习册系列答案
相关题目
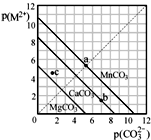 一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
| C、b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D、在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是( )
| A、向Ag2CrO4的浊液中加入AgNO3溶液,Ag2CrO4的Ksp减小 |
| B、将0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-浓度均为0.001 mol?L-1的溶液中,则先产生AgCl沉淀 |
| C、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、该温度下,AgCl在水中的溶解度小于在食盐水中的溶解度 |
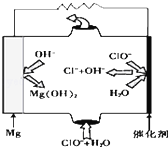 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写: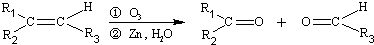 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为: