题目内容
(1)某混合溶液中KBr、KCl、KI的浓度均为0.01mol/L,向该溶液中逐滴滴0.01mol/L AgNO3溶液,产生沉淀的离子先后次序为: ;其沉淀物的颜色分别为 .
(2)常温时,若在1L蒸馏水中加入1滴(约0.05mL)0.1mol/L NaCl溶液,搅拌均匀后再滴入1滴0.1mol/L AgNO3溶液,请估算是否会产生沉淀? (填“会”或“不会”)〔已知常温下Ksp(AgCl)=1.8×10-10〕
(2)常温时,若在1L蒸馏水中加入1滴(约0.05mL)0.1mol/L NaCl溶液,搅拌均匀后再滴入1滴0.1mol/L AgNO3溶液,请估算是否会产生沉淀?
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)AgCl、AgBr、AgI的溶解度是降低的,溶解度小的先析出;AgI是黄色的,AgBr是淡黄色的,AgCl是白色的;
(2)氯化银的溶解平衡为:AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),依据题给的氯离子、银离子的物质的量,混合后体积认为是1L,计算出c(Ag+)、c(Cl-),与Ksp比较判断即可.
(2)氯化银的溶解平衡为:AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),依据题给的氯离子、银离子的物质的量,混合后体积认为是1L,计算出c(Ag+)、c(Cl-),与Ksp比较判断即可.
解答:
解:(1)某混合溶液中KBr、KCl、KI的浓度均为0.01mol?L-1,向该溶液中逐滴加入0.01mol?L-1AgNO3溶液,依据氯化银、溴化银、碘化银阴阳离子比相同,可以用溶度积常数比较判断,溶解性大小顺序是AgCl>AgBr>AgI-、所以生成沉淀的顺序是先生成溶解度小的,在生成溶解度较大的沉淀,先后产生沉淀的离子次序为I-、Br-、Cl-;生成的沉淀分别为碘化银沉淀,溴化银沉淀,氯化银沉淀,颜色分别为:黄色、浅黄色、白色;故答案为:I-、Br-、Cl-;黄色、浅黄色、白色;
(2)由AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),混合后溶液体积是1L,n(Cl-)=n(Ag+)=0.1mol/L×5×10-5L=5×10-6mol/L,故c(Ag+)c(Cl-)=5×10-6mol/L×5×10-6mol/L=2.5×10-11mol2?L-2<1.8×10-10mol2?L-2,故无AgCl沉淀析出;故答案为:不会.
(2)由AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),混合后溶液体积是1L,n(Cl-)=n(Ag+)=0.1mol/L×5×10-5L=5×10-6mol/L,故c(Ag+)c(Cl-)=5×10-6mol/L×5×10-6mol/L=2.5×10-11mol2?L-2<1.8×10-10mol2?L-2,故无AgCl沉淀析出;故答案为:不会.
点评:本题考查了物质溶解性的比较依据和沉淀顺序判断,沉淀现象的判断,理解结构相似的物质溶解性,可以用沉淀溶度积常数大小判断是解题关键.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
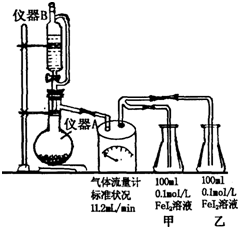 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
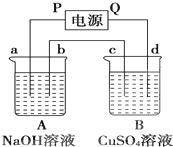 按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:
按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答: 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写: