题目内容
4.已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.M和W均有“生物金属”之称,M4+和氩原子的核外电子排布相同;W处于周期表中第8列.请回答下列问题:(1)1mol B2A2分子中含σ键的数目是3 NA(或1.806×1024).
(2)BC2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图1所示.则该晶体的类型属于原子晶体(选填“分子”“原子”“离子”或“金属”);该晶体中B原子轨道的杂化类型为sp3.
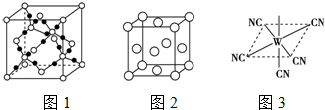
(3)“生物金属”M内部原子的堆积方式与铜相同;都是面心立方堆积方式,如图2.则晶胞中M原子的配位数为12;若该晶胞的密度为ρ g•cm-3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g•mol-1,则该晶胞的“边长”为$\root{3}{\frac{4Mr}{ρ{N}_{A}}}$.
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.①W元素基态原子价电子排布式为3d64s2.
②已知CN-与N2(一种分子)互为等电子体,则1个CN-中π键数目为2NA.
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]-生成,则[D(OH)4]-中存在abc.
a.共价键 b.配位键 c.σ键 d.π键.
分析 A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;C原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以C为氧元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;D原子的最外层电子数等于其周期序数,D原子的电子层数是A的3倍,D为铝元素,M4+离子和氩原子的核外电子排布相同,则M为22号元素,是钛元素,W处于周期表中第8列,则为第ⅥⅡ族元素,且位于前四周期,则可知W为铁元素,据此答题.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;C原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以C为氧元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;D原子的最外层电子数等于其周期序数,D原子的电子层数是A的3倍,D为铝元素,M4+离子和氩原子的核外电子排布相同,则M为22号元素,是钛元素,W处于周期表中第8列,则为第ⅥⅡ族元素,且位于前四周期,则可知W为铁元素,所以A为氢元素;B为碳元素;C为氧元素;D为铝元素;M为钛元素;W为铁元素;
(1)B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024),故答案为:3 NA(或1.806×1024);
(2)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化,故答案为:原子;sp3;
(3)在每个钛的晶胞中含有钛原子数为8×$\frac{1}{8}$=4,配位数为12,设晶胞的连长为a,根据$ρ=\frac{m}{v}$有,$ρ=\frac{\frac{4{M}_{r}}{{N}_{A}}}{{a}^{3}}$,所以a=$\root{3}{\frac{4Mr}{ρ{N}_{A}}}$cm,故答案为:12;$\root{3}{\frac{4Mr}{ρ{N}_{A}}}$cm;
(4)①Fe是26号元素,基态原子价电子排布式为3d64s2,故答案为:3d64s2;
②将C原子及1个电子用“N”代换可得CN-等电子体分子N2,π键数为2NA,故答案为:2NA;N2;
(5)E为铝元素,光谱证实单质E与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键.所以,[Al(OH)4]-中存在共价键、配位键、δ键,故选:abc.
点评 本题以元素推断为载体,考查原子结构、电负性、电离能、化学键与晶体结构、晶胞的计算等知识,是对所学知识的综合考查与运用,难度不大,根据结构推断元素是解题关键.

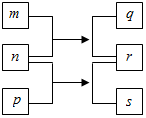 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
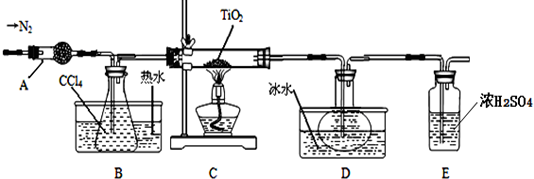
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行.
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(4)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(5)一定条件下,将TiO2溶解并还原为Ti3+,用FeCl3标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 FeCl3标准溶液20mL.
①配制FeCl3标准溶液时,要加入一定量的盐酸,其目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(燃烧热) | |
| B. | 2S(s)+2O2(g)═2SO2(g);△H=-269.8kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 2:17 |
| A. | 氢氧根离子的电子式  | |
| B. | 硫原子的结构示意图 | |
| C. | 一氯乙烷的结构式CH3CH2Cl | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
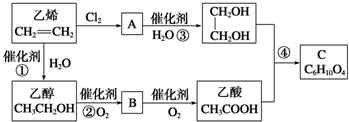
 CH3COOCH2-CH2OOCCH3+2H2O.
CH3COOCH2-CH2OOCCH3+2H2O. ;B分子中有6个原子共面,结构简式为CH2=CH2.
;B分子中有6个原子共面,结构简式为CH2=CH2.