题目内容
6.有X、Y、Z、T、W五种短周期元素,原子序数依次增大.X与T同主族,且X元素与其它元素不在同一周期.Y、Z在同周期中处于相邻位置,它们的单质在通常状况下均为无色气体.W原子的最外层电子数是核外电子层数的2倍.请回答:(1)Z在周期表中的位置为第二周期VIA.
(2)写出X与Z形成的10电子阴离子的化学式OH-.
(3)W的一种氧化物具有漂白性,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式SO2+NH3•H2O═HSO3-+NH4+.
(4)化合物T2Z2的电子式为
 ,其阴阳离子个数比为1:2.
,其阴阳离子个数比为1:2.
分析 X、Y、Z、T、W五种短周期元素,原子序数依次增大,Y、Z在同周期中处于相邻位置,它们的单质在通常状况下均为无色气体,则Y为N元素、Z为O元素;W原子的最外层电子数是核外电子层数的2倍,原子序数大于氧,只能处于第三周期,最外层电子数为6,故W为S元素;X元素与其它元素不在同一周期,则X为H元素;X与T同主族,T的原子序数大于氧,则T为Na,据此进行解答.
解答 解:X、Y、Z、T、W五种短周期元素,原子序数依次增大,Y、Z在同周期中处于相邻位置,它们的单质在通常状况下均为无色气体,则Y为N元素、Z为O元素;W原子的最外层电子数是核外电子层数的2倍,原子序数大于氧,只能处于第三周期,最外层电子数为6,故W为S元素;X元素与其它元素不在同一周期,则X为H元素;X与T同主族,T的原子序数大于氧,则T为Na,
(1)Z为O元素,原子序数为8,在元素周期表位中位于第二周期VIA,
故答案为:第二周期ⅥA族;
(2)H与O形成的10电子阴离子为:OH-,
故答案为:OH-;
(3)W的一种氧化物具有漂白性,该氧化物为SO2,工业上用Y的气态氢化物氨气的水溶液做其吸收剂,吸收剂与足量氧化物反应的离子方程式:SO2+NH3•H2O═HSO3-+NH4+,
故答案为:SO2+NH3•H2O═HSO3-+NH4+;
(4)化合物Na2O2为离子化合物,含有钠离子和过氧根离子,其电子式为 ,化学式Na2O2中含有1个过氧根阴离子和2个钠离子,则阴阳离子之比为1:2,
,化学式Na2O2中含有1个过氧根阴离子和2个钠离子,则阴阳离子之比为1:2,
故答案为: ;1:2.
;1:2.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
12.关于化学研究的意义,下列说法中正确的是( )
①保证人类的生存:诸如在解决人类粮食、能源、合理使用自然资源以及保护环境方面所作的努力和贡献;
②提高人类的生活质量:诸如合成新的材料,物质的净化和纯化等,均使人类衣、食、住、行的条件有大幅度的改善和提高;
③延长人类的寿命:诸如探明生命过程中的化学奥秘,合成新的药物等.
①保证人类的生存:诸如在解决人类粮食、能源、合理使用自然资源以及保护环境方面所作的努力和贡献;
②提高人类的生活质量:诸如合成新的材料,物质的净化和纯化等,均使人类衣、食、住、行的条件有大幅度的改善和提高;
③延长人类的寿命:诸如探明生命过程中的化学奥秘,合成新的药物等.
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | ①②③ |
13.某烃的一种同分异构体只有一种一氯代物,则该烃的分子式可以是 ( )
| A. | C5H12 | B. | C6H14 | C. | C4H10 | D. | C7H16 |
10.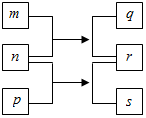 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
11.下列说法正确的是( )
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △H<0且△S<0的反应一定能自发发生 |
18. 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为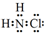 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为NH2Cl+H2O?NH3+HClO.
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为放热(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
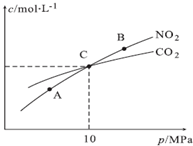
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.(1)①氯胺(NH2Cl)的电子式为
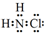 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
15.TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
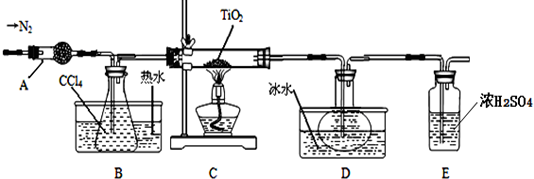
请回答下列问题:
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行.
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(4)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(5)一定条件下,将TiO2溶解并还原为Ti3+,用FeCl3标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 FeCl3标准溶液20mL.
①配制FeCl3标准溶液时,要加入一定量的盐酸,其目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行.
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(4)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(5)一定条件下,将TiO2溶解并还原为Ti3+,用FeCl3标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 FeCl3标准溶液20mL.
①配制FeCl3标准溶液时,要加入一定量的盐酸,其目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
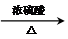 CH3COOCH2-CH2OOCCH3+2H2O.
CH3COOCH2-CH2OOCCH3+2H2O.