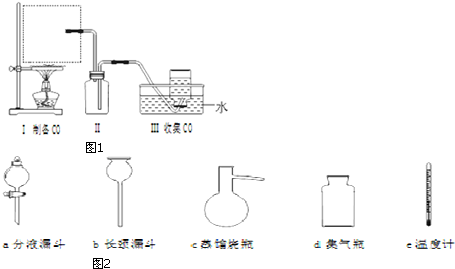
题目内容
5.某有机物的分子式为C5H10O3,其中同时含有-COOH和-OH的有机物有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
分析 某有机物的分子式为C5H10O3,其中同时含有-COOH和-OH,可视为-OH取代戊酸分子中的氢原子后形成的,戊酸有四种:CH3CH2CH2CH2COOH、(CH3)2CHCH2COOH、(CH3)3CCOOH、CH3CH2CH(CH3)COOH,羟基取代它们分子中的氢原子时分别有4种、3种、1种、4种取代方式,故共有12种不同的结构.
解答 解:有机物分子式为C5H10O3,有机物分子中含有1个-COOH、1个-OH,该有机物可以看作,C4H10中2个H原子,分别被-COOH、-OH代替,
若C4H10为正丁烷:CH3CH2CH2CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有2种,取代不同C原子的2个H原子,有6种,相应的同分异构体有8种;
若C4H10为异丁烷:CH3CH(CH2)CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有1种,取代不同C原子的2个H原子,有3种,相应的同分异构体有4种;
故该有机物的可能的结构有8+4=12种,
故选C.
点评 本题考查同分异构体的书写,判断有机物含有的官能团是关键,注意取代中利用定一移二进行判断,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
15.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
| A. | Ⅰ中溶液分层,下层呈紫红色 | B. | Ⅱ中溶液分层,下层呈紫红色 | ||
| C. | Ⅲ中溶液分层,下层呈棕黄色 | D. | Ⅳ中溶液不分层,溶液没有颜色 |
16.下列说法正确的是( )
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
13.某烃的一种同分异构体只有一种一氯代物,则该烃的分子式可以是 ( )
| A. | C5H12 | B. | C6H14 | C. | C4H10 | D. | C7H16 |
20.在标准状况下,下列物质所占体积最大的是( )
| A. | 98gH2SO4 | B. | 56gFe | C. | 44.8LHCI | D. | 6gH2 |
10.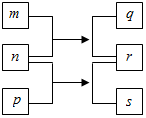 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
18. 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.
(1)①氯胺(NH2Cl)的电子式为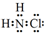 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为NH2Cl+H2O?NH3+HClO.
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为放热(填“放热”或“吸热”)反应.
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
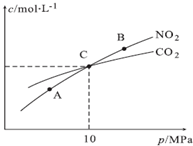
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.(1)①氯胺(NH2Cl)的电子式为
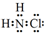 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s)?N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=0.003mol•L-1•min-1.
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)=Kc(B)(填“<”或“>”或“=”).
②A、B、C三点中NO2的转化率最高的是A(填“A”或“B”或“C”)点.
19.下列说法正确的是( )
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |