题目内容
5.如图所示的原电池中,锌电极为( )
| A. | 负极 | B. | 正极 | ||
| C. | 发生还原反应的一极 | D. | 发生氧化反应的一极 |
分析 该装置是原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-═Zn2+、正极反应式为2H++2e-=H2↑,据此分析解答.
解答 解:A、Zn易失电子作负极,故A正确;
B、Zn易失电子作负极,而不是正极,故B错误;
C、发生氧化反应的一极,故C错误;
D、发生氧化反应的一极,故D正确;
故选AD.
点评 本题考查了原电池原理,明确正负极的判断方法、电极反应式的书写即可解答,知道电子流向、电解质溶液中阴阳离子流向,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.在标准状况下,等质量的CH4和CO2比较,下列说法中正确的是( )
| A. | 密度比4:1 | B. | 分子数之比为4:11 | ||
| C. | 体积比11:4 | D. | 物质的量之比为4:11 |
16.下列说法不正确的是( )
| A. | 高级脂肪酸甘油酯的碱性水解叫皂化反应 | |
| B. | 含淀粉或纤维素的物质可以酿酒 | |
| C. | 鸡蛋清的溶液中加入饱和氯化钠溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
13.若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 LCCl4含有的分子数为0.25NA | |
| B. | 常温常压下,8g CH4含有的分子数为0.5NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |
10.关于证明海带中存在碘元素的实验,以下操作正确的是( )
| A. | 海带中的碘可以直接用四氯化碳萃取 | |
| B. | 在蒸发皿中灼烧海带使之变为海带灰 | |
| C. | 将海带灰溶于水中,滴加淀粉溶液,溶液变蓝 | |
| D. | 为了将I-氧化,加入的氧化剂最好选择H2O2溶液 |
17.海藻中含有丰富的、以离子形式存在的碘元素.图是实验室从海藻里提取碘的流程的一部分.
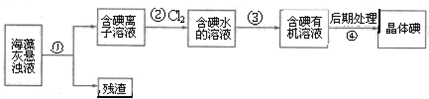
下列判断正确的是( )

下列判断正确的是( )
| A. | 步骤①、③的操作分别是过滤、萃取分液 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是蒸馏 |
14.在一定条件下,对于密闭容器中进行的可逆反应:N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)在2分钟内NH3的反应速率为0.6mol/(L•min),则H2的反应速率为( )
| A. | 0.3 mol/L•min | B. | 0.6 mol/(L•min) | C. | 0.9 mol/(L•min) | D. | 1.2 mol/L•min |
15.镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似.例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
| A. | Li2SO4能溶于水 | |
| B. | LiOH是易溶于水、受热不分解的强碱 | |
| C. | Li遇浓硫酸不产生“钝化”现象 | |
| D. | Li2CO3受热分解,生成Li2O和CO2 |
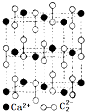 从结构的角度可以帮助我们更好的理解有机物的化学性质.
从结构的角度可以帮助我们更好的理解有机物的化学性质.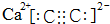 ,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3
,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3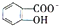 判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是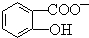 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.