题目内容
10.关于证明海带中存在碘元素的实验,以下操作正确的是( )| A. | 海带中的碘可以直接用四氯化碳萃取 | |
| B. | 在蒸发皿中灼烧海带使之变为海带灰 | |
| C. | 将海带灰溶于水中,滴加淀粉溶液,溶液变蓝 | |
| D. | 为了将I-氧化,加入的氧化剂最好选择H2O2溶液 |
分析 海带中碘元素的分离实验中,在灼烧后的海带灰中加入蒸馏水,煮沸2~3min,再过滤,得到滤液,煮沸的目的是为了加快碘化物在水中的溶解,以使灰烬中的碘离子尽可能多的进入溶液,然后加氧化剂氧化碘离子生成碘单质,再萃取、分液得到含碘单质的有机溶液,最后蒸馏得到碘,以此来解答,
A.海带中的碘元素是化合态,以离子形式存在,不能萃取;
B.海带应在坩埚中灼烧为海带灰,目的除去能燃烧的杂质,容易溶解得到碘离子的溶液;
C.海带灰溶于水,过滤得到含碘离子的溶液,遇到淀粉不变蓝色,碘离子淀粉遇到碘单质变蓝色;
D.过氧化氢做氧化剂不引入新的杂质.
解答 解:A.海带中的碘是化合态,不是碘单质,不能直接用四氯化碳萃取,故A错误;
B.蒸发皿是蒸发浓缩溶液的仪器,固体灼烧应在坩埚内,所以海带应在坩埚中灼烧为海带灰,故B错误;
C.将海带灰溶于水中形成含碘离子的溶液,滴加淀粉溶液,溶液不变蓝,故C错误;
D.过氧化氢做氧化剂不引入新的杂质,为了将I-氧化,加入的氧化剂最好选择H2O2溶液,故D正确;
故选D.
点评 本题考查海水提碘及实验评价,为高频考点,把握提纯碘单质的实验流程及发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意碘离子转化为碘单质需要加氧化剂,题目难度不大.

练习册系列答案
相关题目
8.下列溶液中Cl-浓度最大的是( )
| A. | 1L 0.1mol•L-1 的KCl溶液 | B. | 0.1L 0.2mol•L-1的盐酸溶液 | ||
| C. | 0.1L 0.1 mol•L-1的MgCl2溶液 | D. | 0.1L 0.1mol•L-1的AlCl3溶液 |
1.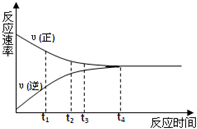 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )| A. | t3时刻,υ(正)>υ(逆) | B. | t4时刻,υ(正)=υ(逆) | ||
| C. | t4时刻,反应达到最大限度 | D. | t4时刻,反应停止 |
5.如图所示的原电池中,锌电极为( )


| A. | 负极 | B. | 正极 | ||
| C. | 发生还原反应的一极 | D. | 发生氧化反应的一极 |
2.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 46 g 14CO2含氧原子数为2 NA | |
| B. | 1 mol Fe与足量的浓盐酸完全反应时转移电子数为3 NA | |
| C. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| D. | 1 mol•L-1 CuCl2溶液中含Cl-数目为2 NA |
19.如表是元素周期表的一部分,针对表中的①~⑩元素,回答下列问题:
(1)在这些元素中,非金属性最强的元素符号是F;
(2)⑧元素的氢化物的化学式为SiH4;
(3)金属性最活泼的元素的原子结构示意图为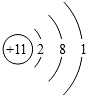 ;
;
(4)能用来雕刻玻璃的氢化物的化学式是HF;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F(用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH(用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是BC(填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)⑧元素的氢化物的化学式为SiH4;
(3)金属性最活泼的元素的原子结构示意图为
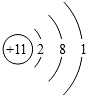 ;
;(4)能用来雕刻玻璃的氢化物的化学式是HF;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F(用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式2NH3+H2SO4=(NH4)2SO4;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH(用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是BC(填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
20.下列物质中既有离子键又有共价键的是( )
| A. | NaCl | B. | H2O | C. | K2O | D. | NaOH |
