题目内容
13.若NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,5.6 LCCl4含有的分子数为0.25NA | |
| B. | 常温常压下,8g CH4含有的分子数为0.5NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |
分析 A、标况下四氯化碳为液态;
B、分子个数N=nNA;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠转移1mol电子来分析;
D、铁和酸反应后的价态可能为+2价,也可能为+3价.
解答 解:A、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、分子个数N=nNA=$\frac{8g}{16g/mol}×{N}_{A}/mol$=0.5NA,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故C错误;
D、铁和酸反应后的价态可能为+2价,也可能为+3价,故0.1mol铁反应后失去的电子数可能为0.2NA个,也可能为0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.锂硅合金-二硫化亚铁电池是一种高能电池,总反应式为:4Li+FeS2═Fe+2Li2S.用该电池为电源电解200mL浓度均为0.1mol/L 的NaCl和CuSO4的混合溶液,当电池消耗1.2g FeS2时,下列有关叙述不正确的是( )
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 阳极产生的气体为Cl2和O2 | |
| C. | 电解后该溶液的pH=2 | |
| D. | 电源正极的电极反应式为:FeS2+4e-═Fe+2S2- |
1.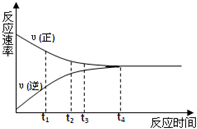 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )| A. | t3时刻,υ(正)>υ(逆) | B. | t4时刻,υ(正)=υ(逆) | ||
| C. | t4时刻,反应达到最大限度 | D. | t4时刻,反应停止 |
8.将1L 0.1mol/L BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5mol/LHCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L1mol/L H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
| A. | (5a+2b) kJ | B. | (4b-10a) kJ | C. | (5a-2b) kJ | D. | (10a+4b) kJ |
5.如图所示的原电池中,锌电极为( )


| A. | 负极 | B. | 正极 | ||
| C. | 发生还原反应的一极 | D. | 发生氧化反应的一极 |
2.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 46 g 14CO2含氧原子数为2 NA | |
| B. | 1 mol Fe与足量的浓盐酸完全反应时转移电子数为3 NA | |
| C. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| D. | 1 mol•L-1 CuCl2溶液中含Cl-数目为2 NA |