题目内容
12.下列溶液中有关物质的量浓度关系错误的是( )| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+ )+c(M+ )=c(OH- )+c(A- ) | |
| B. | pH 相等的 NaHCO3、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(NaHCO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO- )+2c(OH- )=2c(H+ )+c(CH3COOH) | |
| D. | 0.1mol•L-1 的NaHA溶液,其pH=4:c(HA- )>c(H+ )>c(H2A)>c(A2- ) |
分析 A.根据溶液中的电荷守恒分析;
B.pH 相等,则溶液中氢氧根离子浓度相同,根据盐的水解程度判断;
C.溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),以此分析;
D.NaHA溶液,其pH=4,显酸性,说明HA-的电离程度大于水解程度.
解答 解:A.pH=2的HA溶液与pH=12的MOH溶液任意比混合,溶液中存在离子为H+、M+、OH-、A-,电荷守恒为:c(H+ )+c(M+ )=c(OH- )+c(A- ),故A正确;
B.pH 相等,则溶液中氢氧根离子浓度相同,Na2CO3的水解程度比Na2CO3小,则氢氧根离子浓度相同时c(Na2CO3)<c(NaHCO3),氢氧化钠完全电离,氢氧根离子浓度相同时,需要的氢氧化钠的浓度最小,则:c(NaOH)<c(Na2CO3)<c(NaHCO3),故B正确;
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D.NaHA溶液,其pH=4,显酸性,说明HA-的电离程度大于水解程度,则c(A2- )>c(H2A),所以溶液中离子浓度关系为:c(HA- )>c(H+ )>c(A2- )>c(H2A),故D错误.
故选D.
点评 本题考查酸碱溶液的混合、涉及电离、水解、酸碱混合的定性判断等,注重高考常考考点的考查,侧重反应原理的训练,注意把握溶液中的守恒关系,题目难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | 用蒸馏的方法将自来水制成蒸馏水 | B. | 用过滤的方法除去食盐水中的泥沙 | ||
| C. | 用淘洗的方法从沙里淘金 | D. | 用酒精萃取碘水中的碘 |
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
| A. | H+与Cl-数目比为2:3 | B. | Al3+与SO42-数目比为 3:2 | ||
| C. | Na+与Cl-数目比为1:1 | D. | Cl-与SO42-数目比为1:3 |
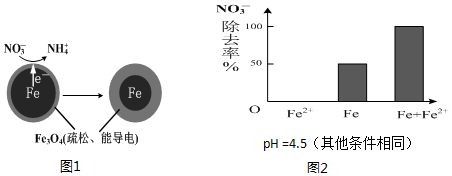 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 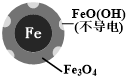 | 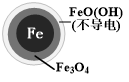 |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:pH=4.5(其他条件相同)
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层.
①对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
| A. | 向NaOH溶液中滴加盐酸至完全中和 | |
| B. | 向Ba(OH)2溶液中滴加盐酸至完全中和 | |
| C. | 向Ba(OH)2溶液中滴加硫酸至完全中和 | |
| D. | 向BaCl2溶液中滴加AgNO3至沉淀完全 |