题目内容
4.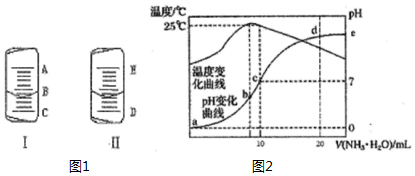 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
分析 (1)用量筒读数时,注意它的分度值,视线要与量筒内液体面相平;用量筒量取液体时,量筒要放平,读数时视线应与凹液面最低处相平;
(2)滴定管刻度0刻度在上,从上到下增大,且最大刻度以下没有刻度;
(3)①用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,反应终点生成醋酸钠溶液显碱性,选择酚酞指示到终点,滴入最后一滴溶液无色变化为红色证明反应达到终点;
②表中数据第三次误差大舍去,计算1、2实验消耗氢氧化钠溶液的平均体积,结合定量关系计算冰醋酸的质量百分含量;
③误差分析依据不足溶液体积变化分析判断,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
(4)①b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大,c点PH=7为氯化铵和一水合氨混合溶液;
②c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析解答;
③25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
解答 解:(1)由图知:量筒A与B之间有五个小格,所以一个小格代表0.2ml,即此量筒的分度值为0.2ml;
凹液面最低处与4mL以上一个刻度处相平,所以液体体积为3.6mL,
故安安为:3.6;
(2)滴定管刻度0刻度在上,从上到下增大,图Ⅱ表示50mL滴定管中液面的位置.如果液面处的 读数是a,且最大刻度以下没有刻度,则滴定管中液体的体积一定大于(50-a) mL,
故答案为:D;
(3)①用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,反应终点生成醋酸钠溶液显碱性,选择酚酞指示到终点,滴入最后一滴溶液无色变化为红色证明反应达到终点,滴定终点的现象是:当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复,
故答案为:酚酞;当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复;
②表中数据第三次误差大舍去,计算1、2实验消耗氢氧化钠溶液的平均体积=$\frac{24.01+23.99}{2}$ml=24ml,
样品中冰醋酸的质量百分含量=$\frac{0.024L×0.10mol/L×60g/mol×\frac{250}{20}}{2.5g}$×100%=72%,
故答案为:72%;
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,读取标准溶液体积增大,测定结果偏高,
故答案为:偏大;
(4)①b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大,水的电离程度大小,a<d<c<b,
故答案为:a<d<c<b;
②c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.5mol/L
故答案为:0.5;
③根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=$\frac{(0.5n-0.5)×1{0}^{-7}}{0.5}$=(n-1)×10-7,
故答案为:(n-1)×10-7.
点评 本题考查常见定量仪器的使用,为高频考点,侧重于学生的分析、实验能力的考查,注意把握常见仪器的使用方法,难度不大.

| A. | 向NaOH溶液中滴加盐酸至完全中和 | |
| B. | 向Ba(OH)2溶液中滴加盐酸至完全中和 | |
| C. | 向Ba(OH)2溶液中滴加硫酸至完全中和 | |
| D. | 向BaCl2溶液中滴加AgNO3至沉淀完全 |
| A. | 硫酸 | B. | 氯化钠溶液 | C. | 熔融氢氧化钠 | D. | 蔗糖固体 |
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
| A. | ①和③ | B. | ③和④ | C. | ②和③ | D. | ②和⑤ |
| A. | SiO2分子由1个硅原子和2个氧原子组成 | |
| B. | 水晶的主要成分是单质硅 | |
| C. | 太阳能电池可采用SiO2制作,其应用有利于节能、环保 | |
| D. | 水玻璃可用作黏合剂和木材防火剂 |
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
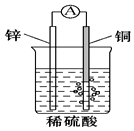
| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| C. | 右图原电池中,电池工作时,SO42-移向电池的正极 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |