题目内容
17.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
分析 强酸性溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.钙离子与碳酸根离子反应;
B.四种离子之间不反应,都不与氢离子反应,都是无色离子;
C.碳酸氢根离子与氢离子反应;
D.铁离子为有色离子.
解答 解:强酸性溶液中存在大量氢离子,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Ca2+、CO32-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故A错误;
B.Mg2+、Cl-、Na+、SO42-之间不反应,都是无色离子,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.HCO3-与氢离子反应,在溶液中不能大量共存,故C错误;
D.Fe3+为有色离子,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
8.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增a g,则该物质为( )
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
2.用下列装置不能达到有关实验目的是( )
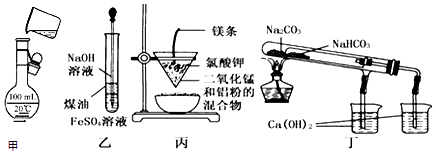

| A. | 用甲图所示装置将溶液定容到100 mL | |
| B. | 用乙图装置制备Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
9.关于如图所示的过程,下列说法不正确的是( )
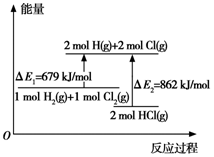

| A. | △E1是该反应的活化能 | B. | △E2是2 mol H-Cl键的总键能 | ||
| C. | 加入催化剂可以改变反应的焓变 | D. | 该反应是一个放热反应 |
6.硫代硫酸钠晶体(Na2S2O3•5H2O)在化学定量分析中常用作基准物质.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验小组设计如下装置模拟工业生产制备硫代硫酸钠晶体(夹持仪器和加热装置省略).
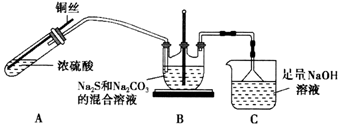
实验步骤如下:
①加热装置A,控制反应速率,使A中产生的气体均匀的通入B中,同时不断搅动,加热.
②当溶液的pH接近7时,停止通入SO2气体.
③将反应后的溶液转移至蒸发皿中,蒸发浓缩,到溶液表面出现晶膜时停止加热.再经冷却结晶、过滤、洗涤,将晶体放入烘箱中,在40℃左右干燥50~60min,得到产品.
回答下列问题:
(1)步骤①,在装置B中反应生成Na2S2O3,已知反应中只有一种变价元素,则B中反应的离子方程式为2S2-+CO32-+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3S2O32-+CO2.
(2)步骤②当溶液的pH接近7时,停止通入SO2气体的原因是Na2S2O3遇酸易分解,二氧化硫过量会使溶液的酸性增强,使产率降低.
(3)若要停止A中的化学反应,除熄灭酒精灯外,还可以采取的措施是将铜丝抽离液面.
(4)完成步骤③中的两处实验操作:蒸发浓缩、冷却结晶.
(5)为探究实验后装置C中溶液的溶质成分,该实验小组又进行了如下实验.
供选择的试剂为:Al(OH)3粉末、酚酞试液、稀硫酸、稀硝酸、Ba(NO3)2溶液

实验步骤如下:
①加热装置A,控制反应速率,使A中产生的气体均匀的通入B中,同时不断搅动,加热.
②当溶液的pH接近7时,停止通入SO2气体.
③将反应后的溶液转移至蒸发皿中,蒸发浓缩,到溶液表面出现晶膜时停止加热.再经冷却结晶、过滤、洗涤,将晶体放入烘箱中,在40℃左右干燥50~60min,得到产品.
回答下列问题:
(1)步骤①,在装置B中反应生成Na2S2O3,已知反应中只有一种变价元素,则B中反应的离子方程式为2S2-+CO32-+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3S2O32-+CO2.
(2)步骤②当溶液的pH接近7时,停止通入SO2气体的原因是Na2S2O3遇酸易分解,二氧化硫过量会使溶液的酸性增强,使产率降低.
(3)若要停止A中的化学反应,除熄灭酒精灯外,还可以采取的措施是将铜丝抽离液面.
(4)完成步骤③中的两处实验操作:蒸发浓缩、冷却结晶.
(5)为探究实验后装置C中溶液的溶质成分,该实验小组又进行了如下实验.
供选择的试剂为:Al(OH)3粉末、酚酞试液、稀硫酸、稀硝酸、Ba(NO3)2溶液
| 序号 | 操作及现象 | 结论 |
| ① | 取少量Al(OH)3粉末于试管中,滴加适量溶液,振荡,白色粉末溶解 | 溶质中一定含有NaOH |
| ② | 取2nL溶液于试管中,滴加足量氯水,氯水褪色丙有气泡产生,再滴加几滴Ba(NO3)2溶液,有白色沉淀产生 | 溶质为NaOH和 Na2CO3、Na2SO3 |
| 取2mL溶液于试管中,若 先加入足量稀硝酸,产生气泡,再滴入几滴Ba(NO3)2溶液,无沉淀产生 | 溶质为为NaOH和Na2CO3 |

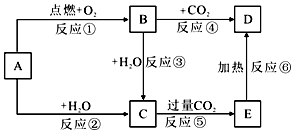
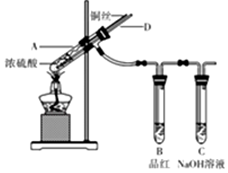 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示: