题目内容
5.A是一种常见的金属单质,B是淡黄色固体,请结合转化关系图回答相关问题.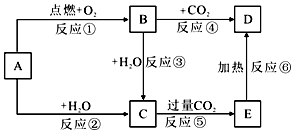
(1)A与氧气还可以生成另一种化合物F.B、F中阴离子与阳离子的数目比分别是1:2、1:2.取等物质的量的B与F分别与等量的水(足量)充分反应,
B所得溶液的质量分数等于(填“大于”“等于”或“小于”)F所得溶液的质量分数.
(2)反应①到⑥中属于氧化还原反应的是①②③④.
(3)现有120g D、E的混合物,充分加热后测得剩余固体质量为89g,则混合物中D的质量分数为30%.
分析 A是一种常见的金属单质,B是淡黄色固体,A在氧气中点燃生成B,则A为Na,B为Na2O2,B与二氧化碳反应生成D为Na2CO3,B与水反应生成C为NaOH,C与过量的二氧化碳反应生成E为NaHCO3,据此答题.
解答 解:A是一种常见的金属单质,B是淡黄色固体,A在氧气中点燃生成B,则A为Na,B为Na2O2,B与二氧化碳反应生成D为Na2CO3,B与水反应生成C为NaOH,C与过量的二氧化碳反应生成E为NaHCO3,
(1)A与氧气还可以生成另一种化合物F为Na2O,B为Na2O2,B、F中阴离子与阳离子的数目比分别是1:2、1:2,取等物质的量的B与F分别与等量的水(足量)充分反应,根据钠元素 守恒可知,B所得溶液的质量分数 等于F所得溶液的质量分数,
故答案为:1:2;1:2; 等于;
(2)根据上面的分析可知,反应①②③④均为氧化还原反应,
故答案为:①②③④;
(3)120g Na2CO3、NaHCO3的混合物,充分加热后测得剩余固体是Na2CO3,质量为89g,设Na2CO3为xmol,NaHCO3为ymol,根据题意有$\left\{\begin{array}{l}{106x+53y=89}\\{106x+84y=120}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.34mol}\\{y=1mol}\end{array}\right.$,所以混合物中Na2CO3的质量分数为$\frac{0.34×106}{120}$×100%=30%,
故答案为:30%.
点评 本题考查无机物推断,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用的考查,题目涉及Na元素单质及其化合物知识,A、B的性质是推断突破口,难度中等.

| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 与酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| C. | 热稳定性:Na2CO3>NaHCO3 | |
| D. | 二者间在一定条件下可相互转化 |
| A. | 0.2 mol NaOH含有0.2NA个NaOH分子 | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.25NA | |
| C. | 常温下,1 mol Cl2与过量NaOH溶液反应,转移电子总数为NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.1NA |
 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:(1)已知在一定温度下,
①C(s)+CO2(g)?2CO(g)△H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3 平衡常数K3.
则K1、K2、K3之间的关系是:K3=K1×K2,△H3=(a+b) kJ/mol(用含a、b的代数式表示).
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
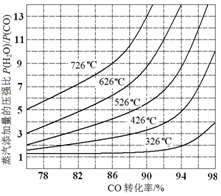
(3)在催化剂存在条件下反应:H2O(g)+CO(g)?CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
| A. | 强度高、弹性好 | B. | 良好的导电、导热性 | ||
| C. | 耐磨、耐化学腐蚀 | D. | 不怕虫蛀 |
| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
| A. | △H4=△H3+△H2+△H1 | B. | △H4=△H3+2△H2+2△H1 | ||
| C. | △H4=△H3+2△H2-2△H1 | D. | △H4=△H3+2△H2-△H1 |
| A. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| B. | 将含有0.1mol FeCl3的饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| C. | 1mol/L的氯化钠溶液中,所含离子数为NA | |
| D. | 常温下,CO和N2混合物共2.8g,所含有的原子数为0.1NA |