题目内容
10.下列说法中不正确的是( )| A. | 不慎将酸溅到眼中,应立即用水洗,边洗边眨眼睛 | |
| B. | 不慎将少量浓硫酸沾到皮肤上,应立即用大量水洗,然后涂上硼酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布扑灭 |
分析 A.酸溅到眼睛中,为了降低伤害,应该立即用水冲洗,且边洗边眨眼睛;
B.将浓硫酸溶液沾到皮肤上,应该立即用干抹布擦去;
C.汽油、煤油的密度小于水的密度;
D.从灭火的原理和方法分析,灭火的方法有:(1)与空气(或氧气)隔绝;(2)降温到可燃物的着火点以下;(3)撤走可燃物.
解答 解:A.酸具有腐蚀性,若不慎将酸溅到眼中,应立即用水冲洗,同时边洗边眨眼睛,故A正确;
B.不慎将浓硫酸溶液沾到皮肤上,应该立即用干抹布擦去,然后用大量水冲洗,然后涂上碳酸氢钠中和,故B正确;
C.汽油、煤油的密度小于水的密度,汽油、煤油燃烧时,用自来水灭火时不但不能灭火,而且能扩大燃烧面积,故C错误;
D.酒精灯着火时,由于水的密度大于酒精,不能用水灭火,可以用湿抹布盖灭,故D正确;
故选C.
点评 本题考查了化学安全事故及处理方法,题目难度不大,注意掌握正确的化学实验基本操作方法,能够正确判断化学安全事故处理方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
20.化学与人类生活、能源开发、资源利用等密切相关.下列说法正确的是( )
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
1.下列电离方程式中,正确的是( )
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
18.已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-,②2FeCl2+Cl2═2FeCl3,③2FeCl3+2KI═2FeCl2+2KCl+I2,④ClO3-+5Cl-+6H+═3Cl2+3H2O,下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
15.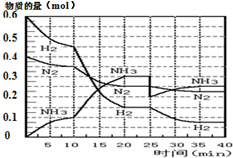 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})({\frac{0.15mol}{2L})}^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于 K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a>0;△S>0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l)=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})({\frac{0.15mol}{2L})}^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于 K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l)=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.
2.一份100ml 0.2mol/L的NaCl溶液,下列哪个选项与该溶液中的Cl-浓度相同( )
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
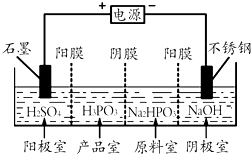 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.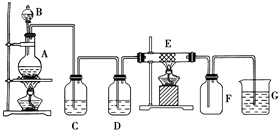 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: