题目内容
6.钾是比钠活泼的金属,与水反应的产物与钠相似:2K+2H2O=2KOH+H2↑.将少量金属钾投入下列物质的水溶液中,有气体放出且溶液质量减轻的是( )| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
分析 钾和盐溶液的反应实质是先与水反应生成氢氧化钾和氢气,生成的氢氧化钾在于盐发生复分解反应,如果溶液质量减轻,说明从溶液中放出气体的质量大于溶液增加的质量,根据金属钠和所给物质间的反应情况来回答.
解答 解:A、钾和水的反应方程式为:2K+2H2O=2KOH+H2↑,生成的氢氧化钾和CuSO4反应,反应方程式为:2KOH+CuSO4=K2SO4+Cu(OH)2↓,将两个方程式相加得2K+2H2O+CuSO4=H2↑+K2SO4+Cu(OH)2↓,根据方程式知,溶液质量减轻,减轻的质量=m(Cu(OH)2)+m(H2)-m(K),故A符合;
B、钾和水的反应方程式为:2K+2H2O=2KOH+H2↑,生成的氢氧化钾和NaOH不反应,所以溶液质量增加,溶液增加的质量=m(K)-m(H2),故B不符合;
C、钾和水的反应方程式为:2K+2H2O=2KOH+H2↑,生成的氢氧化钾和H2SO4反应生成盐和水,反应方程式为:2KOH+H2SO4=K2SO4+2H2O,所以溶液质量增加,溶液增加的质量=m(K)-m(H2),故C不符合;
D、钾和水的反应方程式为:2K+2H2O=2KOH+H2↑,生成的氢氧化钾和盐酸反应生成盐和水,反应方程式为:KOH+HCl=KCl+H2O,所以溶液质量增加,溶液增加的质量=m(K)-m(H2),故D不符合;
故选A.
点评 本题考查了钾的性质,注意钾与盐溶液反应时,先与水反应,生成的氢氧化钾再与盐发生复分解反应,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
16. Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
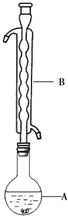
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过、后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为了测产品的纯度,称取7.40g产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
列式并计算所得产品的纯度103.2%,你认为影响纯度测定的主要原因是含有的Na2SO3也会和I2发生反应,从而影响纯度(不考虑操作引起误差).
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过、后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为了测产品的纯度,称取7.40g产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
17.氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备流程图如下:
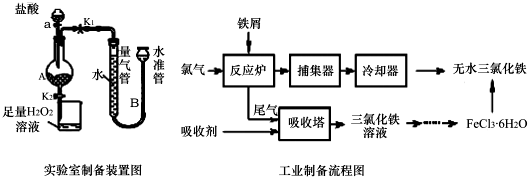
已知:(1)无水FeCl3熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.

已知:(1)无水FeCl3熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
1.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
11.下列反应既是吸热反应,又是氧化还原反应的是( )
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |
18.下列离子方程式正确的是( )
| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
15.下列相关实验能达到预期目的是( )
| 选项 | 实验操作 | 实验目的 |
| A. | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化. | 验证浓度对化学平衡的影响 |
| B. | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢. | 验证固体接触面积对化学反应速率的影响 |
| C. | 相同温度下,两只试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体. | 验证不同催化剂对H2O2分解速率的影响 |
| D. | 将SO2气体通入溴水中,观察溶液颜色的变化 | 证明SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
14.李强在学习了高中化学《铁及其化合物》一节的知识后,对初中“铁丝在氧气中燃烧”实验中的产物产生了疑惑,他认为燃烧时溅落下来的黑色物质中除了Fe3O4外可能还含有其他物质,为了验证自己的猜想,他在实验室中重做该实验,并进行了如下探究活动:查阅资料:①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种,FeO高温时极易被氧化为Fe2O3,而Fe2O3在高温时又容易分解成Fe3O4和一种气体;②铁的氧化物的分解温度及铁的熔点:
(1)根据以上资料,李强提出猜想:黑色物质的成分可能为Fe和Fe3O4.为了确定黑色物质的成分,李强设计了如下几个实验方案:
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.
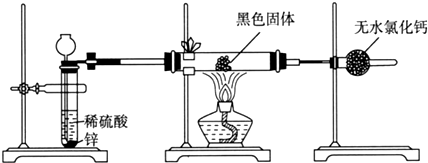
a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
方案1:取该黑色物质溶于足量的稀硫酸中,观察是否有大量气体生成.
方案2:称取碾碎成粉末状的黑色物质a g,在空气中充分灼烧,待反应完全后,在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b的关系.
方案3:取少量碾碎成粉末状的黑色物质,用磁铁吸引,看是否被吸起.
你认为能够证明李强猜想的合理实验方案是方案2,其他方案不合理的原因是黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象(只说其中的一个理由).
(2)针对李强的质疑,研究性学习小组又设计了新的探究方案,装置如下图所示.

a.若反应都进行完全,要想确定黑色固体成分必须测定下列物理量中的②③⑤(只填序号).
①通入氢气体积V ②反应前,黑色固体+硬质玻璃管的总质量m1 ③完全反应后黑色固体+硬质玻璃管的总质量m2 ④实验前,干燥管质量m3 ⑤硬质玻璃管质量m4 ⑥锌粒质量m5 ⑦稀硫酸中含溶质的量n ⑧实验后,干燥管质量m6.
b.根据测定的实验数据,计算出黑色固体中Fe3O4的质量分数为$\frac{29(m1-m2)}{8(m2-m3)}$.
(3)向一定量FeO、Fe和Fe3O4的混合物中加入100 mL l.5 mol•L-1的盐酸,使混合物完全溶解,放出224mL(标准状况)气体,再向反应后的溶液中加入1 mol•L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少为C
A.90 mL B.100 mL C.150 mL D.200 mL.