题目内容
18.下列离子方程式正确的是( )| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.苏打为碳酸钠,应该为碳酸根离子;
B.过氧化钠在离子方程式中不能拆开;
C.二氧化硫过量,二者反应生成亚硫酸氢铵;
D.氢离子、氢氧根的计量数错误.
解答 解:A.澄清石灰水与少量苏打溶液混合,二者反应生成碳酸钙沉淀和氢氧化钠,正确的离子方程式为:Ca2++CO32-═CaCO3↓,故A错误;
B.过氧化钠溶于水生成氢氧化钠和氧气,过氧化钠需要保留化学式,正确的离子方程式为:2Na2O2+2H2O═4OH-+4Na++O2↑,故B错误;
C.将过量二氧化硫气体通入氨水中,反应生成亚硫酸氢铵,反应的离子方程式为:SO2+NH3•H2O═HSO3-+NH4+,故C正确;
D.向Ba(OH)2溶液中滴加稀硫酸,反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
6.钾是比钠活泼的金属,与水反应的产物与钠相似:2K+2H2O=2KOH+H2↑.将少量金属钾投入下列物质的水溶液中,有气体放出且溶液质量减轻的是( )
| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
13.将10℃的0.2mol N2O4置于2L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2 (g).下列结论能说明上述反应在该条件下已经达到平衡状态的是( )
①烧瓶内气体的平均相对分子质量不再变化
②NO2的物质的量浓度不再改变
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤烧瓶内气体的颜色不再加深
⑥N2O4的消耗速率与NO2的生成速率之比为1:2
⑦NO2生成速率与NO2消耗速率相等
⑧烧瓶内气体的密度不再变化.
①烧瓶内气体的平均相对分子质量不再变化
②NO2的物质的量浓度不再改变
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤烧瓶内气体的颜色不再加深
⑥N2O4的消耗速率与NO2的生成速率之比为1:2
⑦NO2生成速率与NO2消耗速率相等
⑧烧瓶内气体的密度不再变化.
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
3.如图是向100mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
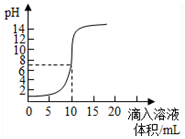

| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
10.不能用有关胶体的观点解释的现象是( )
| A. | 在江河入海处易形成三角洲 | |
| B. | AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀 | |
| C. | 卤水点豆腐 | |
| D. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 |
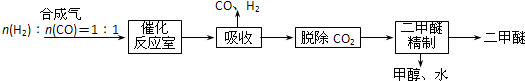
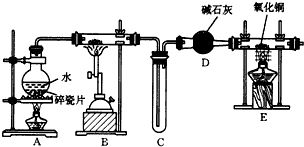
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.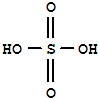 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(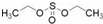 ).
).