题目内容
11.下列反应既属于氧化还原反应,又属于放热反应的是( )| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |
分析 含元素化合价变化的反应,为氧化还原反应;反应物总能量大于生成物总能量,则反应为放热反应,以此来解答.
解答 解:A.灼热的碳与二氧化碳的反应为吸热反应,故A错误;
B.盐酸与烧碱发生中和反应,不是氧化还原反应,故B错误;
C.乙醇燃烧生成二氧化碳和水,为氧化还原反应,且为放热反应,故C正确;
D.氢氧化钡晶体与氯化铵晶体在常温下的反应为吸热反应,且不是氧化还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应和反应中的热效应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应、吸热反应判断的考查,注意归纳常见的放热、吸热反应及从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
10.某柔性燃料电池(以甲醇为燃料,酸性介质)结构示意如图.下列有关说法正确的是( )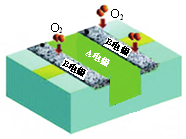

| A. | 电池工作时,电子由A电极经外电路流向B电极 | |
| B. | 电池工作时,减少的化学能完全转化为电能 | |
| C. | A电极发生的电极反应为:CH3OH-6e-+H2O═CO2+6H+ | |
| D. | B电极每消耗1 mol O2,电池中减少4 mol H+ |
8.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含有大量Fe3+的溶液中:Na+、Fe2+、Br-、SO42- | |
| B. | 1.0 mol/L KMnO4的溶液中:H+、Na+、Cl-、SO42- | |
| C. | 能与铝反应放出H2的溶液中:K+、Mg2+、SO42-、NO3- | |
| D. | 水电离的c(H+)和C(OH-)之积为l×l0-20mol2•L-2的溶液中:Na+、K+、CO32-、Cl- |
16.下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
| A. | Ca(HCO3)2溶液与Ca(OH)2反应 | B. | Fe 与 O2反应 | ||
| C. | NaAlO2溶液与CO2反应 | D. | NH4HCO3溶液与NaOH反应 |
20.某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步( ):
①把盛有溶液的分液漏斗固定在铁架台上;
②检验分液漏斗活塞和上口玻璃塞是否漏液;
③把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
④压住分液漏斗玻璃塞倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
⑤从分液漏斗上口倒出上层水溶液;
⑥放开活塞,用烧杯接收下层溶液;
⑦将漏斗上口的玻璃塞打开,或使玻璃塞上的凹槽或小孔对准漏斗口上的小孔;
⑧静置、分层.
①把盛有溶液的分液漏斗固定在铁架台上;
②检验分液漏斗活塞和上口玻璃塞是否漏液;
③把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
④压住分液漏斗玻璃塞倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
⑤从分液漏斗上口倒出上层水溶液;
⑥放开活塞,用烧杯接收下层溶液;
⑦将漏斗上口的玻璃塞打开,或使玻璃塞上的凹槽或小孔对准漏斗口上的小孔;
⑧静置、分层.
| A. | ②③④①⑧⑦⑤⑥ | B. | ②③④①⑧⑦⑥⑤ | C. | ②①③④⑧⑦⑥⑤ | D. | ②③④⑧①⑦⑥⑤ |
1.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、Cu2+、NH4+、Cl- | D. | Na+、K+、NO3-、HCO3- |
 .G的结构简式为
.G的结构简式为 .
.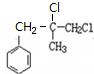 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$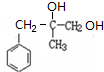 +2NaCl.
+2NaCl.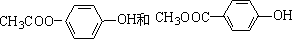 .
.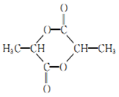 的合成路线:
的合成路线: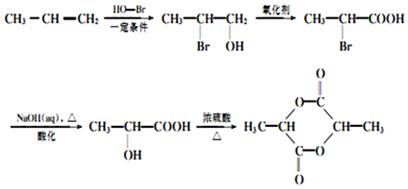 .
.